加载骨形态发生蛋白 2 (rhBMP2) 的丝素支架以增强骨组织工程中的骨诱导性
摘要
在生物医学应用中,对丝素蛋白 (SF) 支架配方的需求不断增加。 SF 通过戊二醛与不同比例的骨诱导重组人骨形态发生蛋白-2 (rhBMP2) 交联。 (i) 3% SF 没有 rhBMP2 (SF),(ii) 3% SF 和等量 rhBMP2 (SF+BMP2),和 (iii) 12% SF 和 3% rhBMP2 (4SF+BMP2),以及这些溶液用于基于静电纺丝的纳米支架制造,以评估具有 rhBMP2 的 SF 支架增加的骨诱导潜力。应力-应变关系表明添加rhBMP2后纤维的机械强度没有损失,并且支架的机械强度随着SF浓度的增加而提高。溶胀研究表明,rhBMP2 结合增加了支架的保水能力。发现 hMSCs 在共轭支架中的活力更高,并且支架对客体细胞没有任何细胞毒性。发现细胞在体外和体内条件下在缀合支架中具有更高的碱性磷酸酶活性,这建立了新构建体增加的骨诱导性。发现支架对体内骨形成也有效。
背景
骨骼的再生能力可以自行修复小骨折。骨骼形成,然后结合,最后重建骨骼的原始形状和形式。然而,这种能力是有限的,因此需要使用自体移植物或同种异体移植物进行治疗 [1]。同种异体移植涉及从可能引起免疫反应的单独供体那里获得骨骼。自体移植,从患者自己的身体中获取骨骼不会产生免疫问题,但会受到足够数量的可用骨骼的限制 [2,3,4]。
组织工程被认为是一种潜在的技术,可以克服同种异体移植和自体移植的免疫学限制。通过组织工程,人类间充质干细胞或骨肉瘤细胞 (MG63) 等特化细胞在合适的环境下在预制支架上培养,然后将该细胞和支架系统用作移植物 [5, 6]。
支架用于为细胞提供锚定和生化生态位,以供细胞存活和增殖。几个属性即。在选择用于制造支架的材料时,应考虑机械强度、骨诱导、生物再吸收、分级孔隙率和生物相容性。骨诱导(骨形成的诱导)是用于制造骨组织工程 (BTE) 支架的材料所需的特性之一 [7]。具有成骨因子的支架可有效模拟骨组织再生过程,该过程将血管生成和成骨结合起来,可能会募集祖细胞及其分化。骨形态发生蛋白 (BMPs) 是一类诱导骨形成的生长因子,与脱矿骨基质 (DBM) 和磷酸钙一起被提议用于 BTE 应用 [8,9,10]。
几个小组报告了使用金属、陶瓷、合成聚合物和复合材料以及丝素蛋白作为 BTE 支架制造的潜在材料。丝素蛋白 (SF) 因其卓越的机械和生物相容性特性而被报道为适用于组织工程应用支架制造的材料 [5]。迄今为止,尚未发表评估 BMPs 与 SF 电纺纳米支架的联合益处的报告。
在这里,我们报告了新型重组人骨形态发生蛋白-2 (rhBMP2) 共轭 SF 电纺纳米纤维支架的制造。将支架与纯 SF 支架进行比较,以阐明 rhBMP2 结合对骨诱导的影响。还测量了细胞活力和细胞增殖特性,以确定支架在新的和更好的骨组织工程应用中的效力。
方法
SF/BMP2水溶液的制备
起初,SF 是从蚕的茧中分离出来的,Bombyx mori , 作为水溶液。遵循既定的协议,稍作修改 [11]。将茧在 100 mL 0.02 M Na2CO3 中煮沸 20 分钟,然后用蒸馏水彻底冲洗以去除多余的水溶性丝胶和蜡。然后将提取的丝心蛋白溶解在 9 M 溴化锂溶液中 60 °C 4 小时,并进一步用水透析 4 天。最终浓度是通过称量干燥后的干物质来确定的,结果为 7% w /v .然后将该溶液浓缩至不同浓度后使用 1 L 25% 聚乙二醇 (PEG, 10,000 g mol -1 ) 室温下的溶液。通过用蒸馏水稀释制备稀释的SF水溶液,并且所有溶液在10°C下储存直至进一步处理。将重组人骨形态发生蛋白 2 (rhBMP2) 的冻干粉溶解在 PBS (pH 3.8) 中。用 0.22 μm 注射器过滤器对蛋白质溶液进行灭菌,并在连续搅拌下将其作为水溶液添加到每个丝心蛋白溶液中。戊二醛介导的交联用于将 BMP 与丝心蛋白相关联。简而言之,对于 10 mL 反应混合物,使用 200 μL 戊二醛和 40 μL、12 N HCl 作为基团激活剂使 6% 丝素蛋白和 1% rhBMP2 各 5 mL 交联。通过此程序,制备了三种溶液:(i) 3% 丝素蛋白,不含 rhBMP2 (SF),(ii) 3% 丝素蛋白与 0.5% rhBMP2 (SF+rhBMP2),以及 (iii) 12% 丝素蛋白与0.125% 的 rhBMP2,如 (ii) (4SF+rhBMP2)。这些溶液用于制备支架的静电纺丝工艺。
静电纺丝支架制作
对于支架制造,将每种溶液装入带有不锈钢针(25G,内径 0.26 毫米,Sigma Aldrich)的 5 毫升玻璃注射器中,该注射器连接到 5.5 kV 直流电源。为了制备纤维,出口流速保持在 0.4 mL h -1 使用注射泵,将电纺纤维收集在与毛细管尖端保持 15 cm 间隙的铝箔上。样品采集时间为4 h。
扫描电子显微镜
对于制备的支架的形态学检查,使用蔡司 EVO40SEM 进行 SEM。在进一步处理扫描图像之前,样品被溅射镀金。纤维直径的确定是通过平均图像帧中10根随机纤维的直径来完成的。
脚手架的力学性能
使用 Instron 单柱台式机电测试仪(型号 3345,Instron,Canton,MA)进行压缩实验以评估开发的支架的机械性能。通过长时间静电纺丝获得的直径为 0.2 mm 的纤维用于从 25 °C 和 50% 湿度下的应力-应变曲线确定拉伸强度和断裂伸长率。
肿胀研究
为了测量溶胀率,将每种制剂在 37°C 下溶解在 PBS (pH 7.4) 中。在预定的时间间隔取出样品,并使用电子天平测量干重。继续测试直至达到平衡重量。溶胀率表示为:
$$ \mathrm{膨胀}\ \mathrm{ratio}\left(\%\right)=\frac{W\mathrm{s}-W\mathrm{o}}{W\mathrm{o}} $$其中,W o =纳米纤维基质的初始干重和 W s =每个时间点溶胀的纳米纤维基质的重量。
细胞培养
本研究中使用人类间充质干细胞 (hMSCs) 来评估制造的纳米支架的骨诱导潜力。将 hMSC 培养并维持在含有 10% 胎牛血清和 1% 青霉素的 DMEM 中,在 37°C 下,在 5% CO2 加湿气氛中,直至达到 90% 汇合。然后将细胞胰蛋白酶消化、离心并重悬于培养基中进行定量。
通过用乙醇洗涤并用紫外线照射 30 分钟对支架进行消毒,然后用 PBS (pH 7.4) 洗涤。在细胞接种前对支架进行 DMEM 处理。将 20 μL 细胞悬液滴加到每个支架和塑料薄膜中作为对照。支架在潮湿的气氛(37°C,5% CO2)中保持静止 30 分钟。然后,支架在DMEM中培养21天,每隔一天定期补充培养基。
细胞粘附测定
为了评估细胞与支架的粘附能力,根据文献中的方法稍作修改,在初始接种 1、3 和 6 小时后计算未粘附细胞的数量 [6]。收集细胞培养基并用血细胞计数器进行细胞计数。初始接种计数与未粘附细胞数之间的差异被认为是粘附细胞数。结果根据以下等式以粘附百分比表示:
$$ \%\mathrm{Adhesion}=\frac{\mathrm{Initial}\ \mathrm{seeding}-\mathrm{number}\ \mathrm{of}\ \mathrm{non}\ \mathrm{adherent}\kern0 .5em \mathrm{cells}}{\mathrm{Initial}\ \mathrm{seeding}}\times 100 $$细胞毒性分析
为了测量纳米纤维基质的毒性作用,进行了 MTT 测定。在各自的时间范围后,将构建体在 MTT 溶液(1 mg mL -1 原液在 PBS(pH 7.4)中以 1:10 的比例稀释)并孵育 4 小时。在此孵育期间,活细胞将 MTT 转化为甲盐。通过加入DMSO溶解甲盐并放置20分钟。使用酶标仪记录570 nm处的吸光度变化,定量测定来源于甲臜盐的吸光度。
细胞增殖分析
进行 Alamar blue (AB) 染料还原测定以确定支架内细胞的增殖。支架在用 DMEM 稀释的染料中孵育 4 小时,并通过分光光度法测量染料的减少。 AB 减少百分比计算如下:
$$ \%\mathrm{AB}\ \mathrm{reduction}=\left[\left({\varepsilon}_{\mathrm{ox}}{\lambda}_2\right)\left(\mathrm{A} {\lambda}_1\right)-\left({\varepsilon}_{\mathrm{ox}}{\lambda}_1\right)\left(\mathrm{A}{\lambda}_2\right)/\ left({\varepsilon}_{\mathrm{red}}{\lambda}_1\right)\left({\mathrm{A}}^{'}{\lambda}_2\right)-\left({\ varepsilon}_{\mathrm{red}}{\lambda}_2\right)\left({\mathrm{A}}^{'}{\lambda}_1\right)\right]\times 100 $$其中,ελ 1 =阿拉玛蓝在 570 nm 和 ελ 处的摩尔消光系数 2 =阿拉玛蓝在 600 nm 处的摩尔消光系数,在氧化 (ε ox) 和还原 (ε 红色)形式。 Aλ 1 和 Aλ 2表示测试孔的吸光度。
A’λ 1 =570 nm 处阴性对照孔的吸光度。
A’λ 2 =600 nm 处阴性对照孔的吸光度。
ALP 检测
根据试剂盒中的制造商方案测量支架内培养的 hMSC 产生的碱性磷酸酶 (ALP) [12]。简而言之,无菌 PBS (pH 7.4) 用于洗涤和孵育支架,然后用 1 mL Tris 缓冲液(1 M,pH 8.0)匀浆,并在冰上超声 3 分钟。然后将 25 μL 裂解物与 1 mL 对硝基苯磷酸盐溶液 (16 mM) 在 30 °C 下孵育 5 分钟。在 405 nm 处进行分光光度测量以监测 ALP 存在下对硝基苯酚的产生。
体内 ALP 活动
取 9 只雄性无胸腺裸鼠,每只重 100-120 克,并在双侧腹部肌肉处解剖以制作小袋。裸鼠模型被用来证明支架在体内的骨诱导潜力。将三种类型的支架(5 mm × 5 mm)中的一种分别切割并装入肌肉袋中。然后用不可吸收的缝线封闭小袋。手术 14 天后,通过切除腹直肌取出植入物并保存在 PBS 中。切除肌瓣,获得外植体组织,将其在提取缓冲液中匀浆以释放碱性磷酸酶。取50 μL等分溶液用于测定ALP活性。
统计分析
所有实验一式三份进行,除非提及,否则呈现的数据格式为样品的平均值±标准偏差(SD)。使用统计软件 Origin 6.0 进行一种方差分析 (ANOVA),以评估不确定差异和显着差异。 P 0.05或更小的值表示研究组之间存在显着差异。
结果
支架的形态
制造的支架的 SEM 图像(图 1)显示精细旋转的纳米纤维结构。在所有浓度下,SF 和 SF+BMP2 支架中纤维的平均直径似乎相似,范围从 100 到 900 nm,因为发现直径是完成静电纺丝的时间的函数 [13],而 SF发现纳米纤维是均匀的,BMP2 共轭导致纤维直径不均匀。支架的孔径在制造的支架中似乎是均匀的,并且发现与丝心蛋白的浓度无关。 SF的浓度对孔径没有显着影响[11]。
<图片>
制备的支架的 SEM 显微照片。 一 顺丰。 b SF+rhBMP2。 c 4SF+rhBMP2
脚手架的力学性能
纳米纤维支架的应力-应变曲线如图 2 所示。据观察,添加 BMP 不会改变 SF 支架的机械性能,但随着制造材料 (SF) 浓度的增加,基质的拉伸性能得到改善.这可能是由于在交联过程中形成了纤维间键。因此,与高浓度的 SF 纤维相比,低浓度的 SF 纤维没有表现出更好的机械强度。
<图片>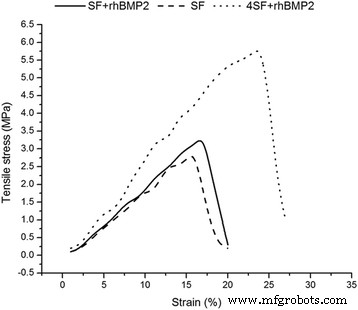
电纺纳米纤维的应力-应变关系。比较(a)SF、(b)SF+rhBMP2和(c)4SF+rhBMP2支架的应力-应变关系
肿胀研究
支架的膨胀率随时间的变化如图 3 所示。支架最初随时间膨胀良好,并在大约 380 分钟内达到平衡。与仅 SF 的支架相比,rhBMP2 连接的纤维吸收了更多的水,这表明由于 BMP2 关联,亲水性口袋增加。 SF 纤维在~ 70% 平衡,而含有 BMP2 的纤维在~ 81% 水平衡。
<图片>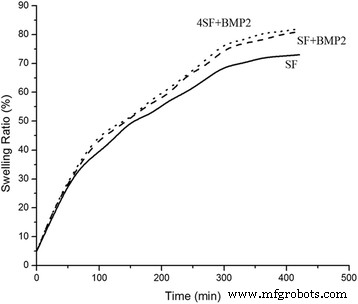
装配式脚手架的膨胀性能。观察SF+rhBMP2和4SF+rhBMP2修饰后SF支架溶胀性能的变化
细胞粘附测定
细胞对支架的粘附是细胞生长和分化诱导所必需的。在本研究中,我们观察到 hMSCs 与支架的粘附良好,hMSC 与 4SF-BMP2、SF-BMP2 和 SF 支架的粘附如图 4 所示。
<图片>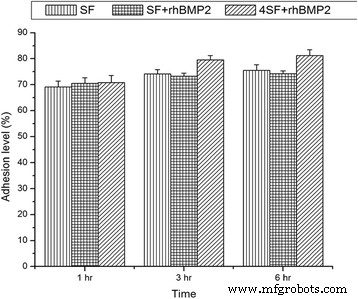
代表三个时间点的粘附百分比与时间的直方图。 (a) SF, (b) SF+rhBMP2 和 (c) 4SF+rhBMP2 支架中粘附水平的变化
在混合支架中存在粘附损失的担忧,这被观察到的结果排除了。与 BMP2 的混合不会降低支架的粘附能力。从图 3 可以明显看出,随着孔径的增加(SF 浓度的降低),细胞对支架的粘附增加,这是众所周知的。三种配方之间的方差分析显着区分了第 3 小时和第 6 小时的变化。然而,第1小时没有观察到显着差异。
细胞毒性测定和细胞增殖测定
在rhBMP2结合的支架中细胞活力显着增加,并且构建的支架不会对所关注的客体细胞产生任何细胞毒性作用(图4),并且在所有支架中细胞增殖良好,相对图5。有一个生存力随天数呈增加趋势,并且 SF+BMP2 支架在每个时间点表现出最小的毒性。方差分析显示三种相关制剂的细胞活力值之间存在显着差异。
<图片>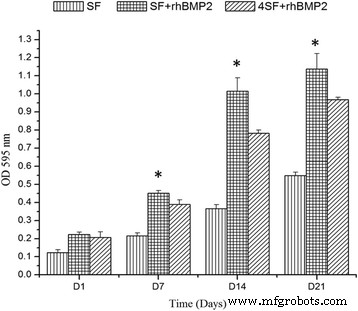
细胞活力测定表示为四个时间点的直方图。细胞活力测定采用MTT法,结果以相对于对照的百分比表示
从图6,可以检查细胞增殖。细胞在所有三种支架制剂中增殖良好,每个时间点在 SF+BMP2 中增殖最好。 SF + BMP2 支架中较大的孔为细胞生长提供了最大的空间。 ANOVA已经很好地确定了组间差异的显着性。
<图片>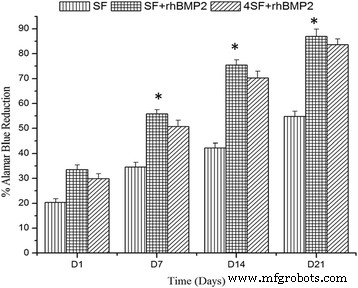
用 SF、SF+BMP2 和 4SF+BMP2 四个时间点的阿拉玛蓝染料减少百分比表示细胞增殖
ALP 检测
ALP 活性是细胞周围环境的骨诱导特性的标准标志物 [13]。在我们的实验中,与仅 SF 的构建体相比,我们观察到 SF+BMP2 构建体中的 ALP 活性更高(图 7)。 SF 纳米结构支架也能够单独表现出骨诱导,但从图 7 和 ANOVA 中可以明显看出,SF+BMP2 支架被证明是相关支架中最好的。随着实验时间的推移,ALP浓度增加,但与SF浓度较低的构建体相比,SF浓度较高的构建体表现出较低的ALP活性。
<图片>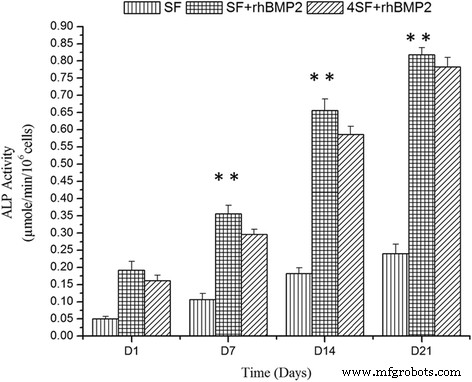
在不同时间点的三种不同支架制造策略中 ALP 活性的表示。 (a) SF (b) SF+rhBMP2 (c) 4SF+rhBMP2 支架
体内 ALP 活动
图8描绘了(a)SF、(b)SF+rhBMP2和(c)4SF+rhBMP2的外植体的ALP活性。正如预期的那样,含有rhBMP2处理的外植体诱导更高的ALP活性,而无rhBMP2支架处理的小鼠产生较低的ALP活性。
<图片>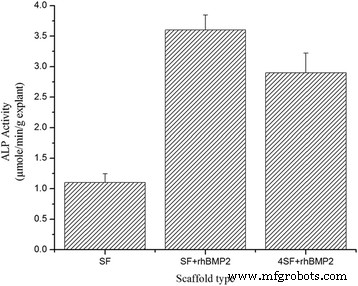
处理后获得的外植体的体内 ALP 活性。利用裸鼠模型证明支架在体内的骨诱导潜力
讨论
基于支架的组织工程已证明其在再生医学中的潜力,并且作为 BTE 的工具取得了令人瞩目的进展。以往的研究已经确定了微结构和结构物理特性在将体外工程细胞支架结构转化为骨组织中的关键作用[14,15,16]。
构建体的最佳机械性能(孔径、拉伸强度等)和生物相容性是细胞定植和组织的潜在特征[17]。所提出的工作描述了骨组织工程支架的制造和表征,利用为相同的材料提出的有益特性的组合。虽然 SF 提供了一个适当的强和生物相容性平台,但嵌入的 rhBMP2 会诱导新骨细胞的形成。 SF 正在被几个小组广泛研究,用于成骨细胞增殖 [18] 和组织再生的不同配方,包括韧带、肌腱、软骨、骨骼、肝脏、皮肤、气管、角膜、神经、鼓膜和膀胱 [19、20]。
我们在研究中使用了 SF 和 SF+rBMP2 的水溶液,因为在制备 SF 溶液时,水溶液优于有机溶剂,因为在有机溶液中 SF 的降解是不利的 [18]。据报道,电纺 SF 纤维具有均匀直径的纤维结构,并且网孔高度多孔,具有相互连接和交叉连接的孔,这也与我们的研究非常一致 [21, 22]。在我们的支架和之前报道的支架中,没有观察到在 SF 纤维中形成珠状结构 [21]。据报道,纯 SF 纤维的直径随着混纺的增加而减小 [11, 21];然而,我们没有观察到由于混合导致的直径损失。但混纺纤维中纤维的均匀性受到干扰,可能是由于rBMP2与SF纤维的结合不均匀。
充足的机械强度是组织支架必不可少的特性。在我们的实验中,纯 SF 的混合增加了纳米纤维的柔韧性,之前的报告也揭示了将 SF 与其他材料混合以产生可使用的混合生物材料时机械性能改善的类似趋势 [21, 23]。因此,我们制造的支架具有组织工程应用所需的基本机械强度和柔韧性。
用于组织工程的支架应该能够将细胞附着在它上面,应该促进细胞增殖和骨诱导,并且应该是细胞毒性最小的,因为它的可接受性更好。早先关于 SF 支架的报道已经确定其无细胞毒性和细胞增殖活性 [21, 24],我们的研究与先前报道的结果非常一致。
由于其骨诱导特性,rhBMP2 正被多个团体用于骨组织工程 [25,26,27]。这些研究表明,在含有 BMP2 的支架上培养的细胞具有更高的 ALP 活性,这是一种骨诱导的生物标志物。随着孵育时间的推移,BMP2 结合的效果得到更好的对比。金等人。利用 BMP2 相关的多孔微球并观察到类似的骨诱导增强 [25]。
结论
我们成功地制造了含有rhBMP2的基于SF的纤维支架。这些支架是同质的,并被发现具有足够的机械性能和生物相容性。进一步的 rhBMP2 关联归因于制造的支架的骨诱导潜力。进一步评估了支架的体内应用,发现适用于涉及骨组织工程的应用。
缩写
- ALP:
-
碱性磷酸酶
- BTE:
-
骨组织工程
- hMSCs:
-
人间充质干细胞
- rhBMP2:
-
重组人骨形态发生蛋白-2
- SF:
-
丝素蛋白
纳米材料


