单独用二氧化钛包覆二氧化硅并用海藻酸钠改性作为重金属离子吸附剂
摘要
在开发有效的重金属离子吸附剂的过程中,以海藻酸盐改性的纳米二氧化硅-二氧化钛为基础合成了新型有机-无机生物杂化复合吸附剂。金属种类 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 的影响;浓度;酸碱度;温度;研究了由海藻酸钠 (ST20-ALG) 初始或改性的二氧化钛涂层二氧化硅 (ST20) 上的吸附。使用Langmuir和Freundlich吸附模型和动力学模型分析金属离子吸附的平衡和动力学数据:伪一级、伪二级、粒子内动力学模型和Elovich。与所有研究的金属离子的初始 ST20 氧化物相比,ST20-ALG 复合材料观察到的最大吸附容量更高,即它们的 ST20-ALG 值为 22.44 mg g - 1 对于 Cu(II) 吸附,19.95 mg g − 1 对于 Zn(II),18.85 mg g − 1 对于 Cd(II) 和 32.49 mg g − 1 对于 Pb(II)。采用氮吸附/解吸等温线、ATR-FTIR、SEM-EDS和pHpzc技术分析了初始二氧化硅-二氧化钛ST20和海藻酸钠改性ST20-ALG吸附剂的结构和性能。
背景
从污水和工业废物进入水中的重金属物种是对环境的严重威胁之一。由于它们的毒性和生物蓄积性,它们对生物体也是危险的。有多种方法可以从水性介质中去除重金属物质,例如离子交换、化学沉淀、膜处理和电凝。这些技术有很多优点,但在某些情况下,它们既昂贵又不是很有效。吸附是用于去除重金属离子的最常见、最有效的技术 [1, 2]。各种吸附剂用于去除水和废水中的污染物。为此,可以使用具有各种功能的改性二氧化硅和基于二氧化硅的系统 [3,4,5,6,7]。二氧化硅细颗粒因其表面结构、高比表面积、生产成本低和易于改性而备受关注[8]。细二氧化钛颗粒由于其独特的性质和几种潜在的技术应用,如颜料、光催化剂、填料和吸附剂,以及它们在太阳能电池和存储设备生产中的应用而备受关注[9]。使用二氧化钛作为吸附剂的优点是表面积大、吸附容量高、稳定性好、无毒、生物和化学惰性以及对无机和有机污染物的高亲和力[10,11,12]。在 George 等人的论文中。 [13],TiO2 纳米粒子成功地用于去除自来水中存在干扰离子的砷、锑、铅和镉。正如许多论文所报道的那样,纳米结构的 TiO2 基吸附剂的特点是由于相对较高的比表面积、良好的机械稳定性、生物相容性和电性能,对无机和有机化合物的光催化性能得到改善 [14]。然而,当纳米尺寸的 TiO2 悬浮液用于吸附金属离子时,由于这种二氧化钛的颗粒尺寸很小,会发生颗粒聚集、活性丧失和回收困难。这些问题可以通过溶胶-凝胶法将纳米二氧化钛固定在二氧化硅等多种基质上来避免。
二氧化硅和二氧化钛复合材料可以以混合物的形式获得,其中两相形成具有弱相互作用的单个颗粒,或者作为本体和一相载体颗粒表面的二氧化钛和二氧化硅的混合物,两者之间紧密接触组件。在使用烷氧基硅烷(在水的存在下)对二氧化硅进行表面改性后,它们会形成反应性有机硅烷醇 (RSi-OH),并作为副产物获得醇。然后有机硅醇与表面的羟基和无机氧化物发生缩合,得到含有 Si-O-M 共价键的有机官能团。具有接枝纳米尺寸 TiO2 的复合微球二氧化硅可以表现出单一氧化物所没有的新特性 [15]。通过将二氧化硅的吸附潜力与纳米二氧化钛的光催化特性相结合,可以创造出具有改进光催化潜力的集成光催化吸附剂。许多研究报告了纳米尺寸的 TiO2 和 SiO2 以及活性炭、碳纳米管和 TiO2 复合材料的协同效应 [16,17,18,19]。根据文献 [20,21,22,23],复合材料中纳米级二氧化硅和二氧化钛之间的相互作用导致二氧化硅-二氧化钛样品的 O1s 和 Ti2p3/2 结合能范围相对于纯 TiO2 发生蓝移从 X 射线光电子能谱 (XPS) 观察到,由于 Ti 4+ 形成了 Ti-O-Si 键 阳离子侵入二氧化硅晶格的四面体位点。 Ti-O-Si键的形成导致Si的电负性大于Ti的电负性,因此Ti上的有效正电荷增加而O上的有效负电荷减少。
海藻酸盐、纤维素和壳聚糖是生物聚合物,可用作控制药物释放的载体、具有调节渗透性的膜、传感器设备和人造肌肉 [24, 25]。它们对重金属离子的吸附能力也被证明适用于单个生物聚合物 [25] 以及复合材料 [26]。因此,纳米TiO2-SiO2复合材料的藻酸盐改性是一种非常简单且廉价的方法,可以防止其颗粒聚集并提高吸附性能。海藻酸钠(ALG)由M(M-blocks)和G(G-blocks)残基序列组成,形成MG序列(MG-blocks)[24]。金属阳离子,例如 Ca(II),被 MG 嵌段的羧酸根螯合导致藻酸盐的交联。这种类型的吸附剂并不为人所知,重金属离子的动力学和吸附的一些基本规则,尤其是伴随着水溶液的光还原作用时,尚未完全了解。在有机-无机复合材料的情况下,氧化物颗粒可以改善热性能、在不同条件下工作的自持能力、与聚合物更好的疏水相互作用以及特定性能,例如对多种化合物的化学结合能力。
用亚铁氰化钾功能化并浸渍在海藻酸钙中的二氧化钛涂层二氧化硅微球用于有效去除水介质中的铯 [27]。发现铯的最大吸附在 pH 值范围 7.5-8.5 和平衡时间 24 小时内达到。珠子的最大吸附容量为 23.55 毫克/克,吸附遵循朗缪尔等温线。 Mina 和 Hering [28] 研究了使用藻酸去除砷的方法。在 pH 4.0 时实现了最佳的除砷持久性和效率。该产率随着铁含量的增加而增加。在初始 As(V) 浓度 400 μg L − 1 120 小时后 pH 值为 4.0,As(V) 去除率等于 94%。在 Fulazzaky 等人的论文中。 [29],证明由于与二氧化钛 PVA-藻酸盐珠的 O-H 官能团相关的价电子,Cd(II) 离子可以以 Cd(0) 的形式沉淀。藻酸盐-TiO2 吸附剂还用于从水和废水中吸附和去除阳离子(亚甲蓝,MB)和阴离子(甲基橙,MO)染料[30]。与纳米粉末样品相比,所得珠粒对 MB 的吸附显着增强(55% vs. 6.5%)。
这项工作的目的是通过用海藻酸盐改性二氧化钛-二氧化硅来合成有机-无机复合材料,并比较初始二氧化硅-二氧化钛和它与海藻酸盐复合对重金属离子的吸附性能。利用吸附动力学、吸附容量、吸附机理分析等方法对Cu(II)、Zn(II)、Cd(II)、Pb(II)等二价金属离子的吸附规律进行分析测定,以及它们与吸附剂结构的关系是本研究开发有效吸附水溶液中重金属的吸附剂的重点。
方法
材料
气相二氧化硅 A-50(乌克兰卡卢什 Chuiko 表面化学研究所的中试装置,比表面积 S =50 m 2 g − 1 ) 被用作初始材料。异丙醇钛 Ti[OCH(CH3)2]4 (TTIP)(Sigma Aldrich,98%)溶解在 2-丙醇(Sigma Aldrich)中用作二氧化钛前体。海藻酸钠(ROTH)和六水氯化钙CaCl2·6H2O(CHEMPUR)用于制备ST20-ALG珠。
复合材料合成
二氧化硅 A-50(在 40 °C 下添加 2-丙醇并搅拌形成精细分散体)通过添加在 2-丙醇中的 TTIP 溶液在 200 °C 下加热 2 小时进行改性,然后在空气中冷却至室温至加水提供 TTIP 水解。然后将混合物加热至 80 °С 以形成无定形二氧化钛。然后在110°С加热以除去溶剂。残留物在空气中 800°C 下煅烧 1 小时。所有操作均在配备有 PTFE 搅拌器和空气吹扫系统的反应器中进行。具有A-50二氧化硅基质和接枝纳米级二氧化钛的最终材料标记为ST20。
通过应用海藻酸钠溶液来改性氧化物吸附剂。将适量的 ST20 与 1% 的海藻酸钠溶液混合。然后使用蠕动泵(PP1 B-05A 型,Zalimp)将混合物以 2.5 cm 3 流速滴加到 2% CaCl2 溶液中 min − 1 .将珠子留在 CaCl2 溶液中 24 小时。然后用蒸馏水洗涤数次。制备的复合吸附剂标记为ST20-ALG。
傅立叶变换红外光谱
为了表征 Cu(II) 和 Pb(II) 吸附前后的 ST20 和 ST20-ALG,使用 Cary 630(安捷伦科技公司)使用衰减全反射模式 (ATR-FTIR) 进行傅里叶变换红外 (FTIR) 光谱分析应用。分析在 4000–400 cm − 1 范围内进行 .
氮吸附-解吸测量
使用 Micromeritic ASAP 2020 吸附分析仪和超高纯度氮气在 77.35 K 下进行氮吸附-解吸测量。所有样品在测量前在 110 °C 下真空脱气 2 小时。比表面积(S BET) 根据标准 BET 方法计算 [31]。总孔容V p 由 p 处的氮吸附量计算 /p 0 ≈ 0.98–0.99,其中 p 和 p 0 分别表示氮气在 77.4 K 时的平衡压力和饱和压力 [32]。
氮解吸数据用于计算孔径分布(PSD,微分f V(R ) ~ dV p/dR 和 f S(R ) ~ dS /dR ) 使用自洽的 r 非负条件下的正则化 (SCR) 程序 (f V(R ) ≥ 0 在任何孔隙半径 R ) 在固定的正则化参数 α =0.01。应用复杂的孔隙模型,在随机聚集体中填充球形 NPNP 之间具有圆柱形 (C) 孔和空隙 (V)(CV/SCR 方法)[33]。
扫描电子显微镜
借助 Quanta 3D FEG (FEI) 设备记录具有能量色散谱 (EDS) 的扫描电子显微镜 (SEM) 图像。使用JEM100CX II仪器记录TEM显微照片。
吸附研究
将 0.1 g 吸附剂加入 20 cm 3 锥形瓶中,在室温下进行批量实验。 含有浓度范围为 50–250 mg L − 1 的 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子的溶液 .样品在机械振动器(Elpin Plus 357 型,波兰)上振动 1 到 240 分钟(振幅 7,180 rpm)。通过Spectr AA 240 FS(Varian)原子吸收光谱仪测量金属离子的浓度。金属离子吸附量(mg/g)按标准方法计算。
为了研究吸附量的影响,每 20 cm 3 使用 0.05、0.1 和 0.15 g ST20 或 ST20-ALG 金属物种的溶液。 Cu(II)、Zn(II)、Cd(II)和Pb(II)的初始浓度为100 mg L − 1 .在 20、40 和 60 °C 下研究了温度对 ST20 和 ST20-ALG 上 Cu(II) 吸附的影响。 Cu(II) 的初始浓度为 100 mg L − 1 吸附剂用量为0.1 g/20 cm 3 (5 克 L − 1 ).
根据初始溶液中和吸附过程后 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子的量之间的差异计算吸附百分比。基于 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 对 ST20 和 ST20-ALG 的吸附研究了相接触时间的影响。每种金属离子的初始浓度为 100 mg L − 1 吸附剂用量为0.1 g/20 cm 3 .不同初始浓度的Cu(II) (50–250 mg L − 1 ) 对使用 ST20 和 ST20-ALG 的吸附进行了检查。溶液pH值采用PHM82型pH计测定。
在本研究中,使用各种扩散和动力学模型(伪一阶 [34]、伪二阶 [35, 36]、粒子内扩散 [37] 和 Elovich [38, 39] 模型)来确定接触时间需要达到平衡并了解吸附过程的速率。关于处理速率的知识提供了有关金属物质吸附对 ST20 和 ST20-ALG 影响的有用信息。
下式描述的伪一级模型假设吸附速率与未被重金属或其他杂质占据的自由位点的数量成正比。
$$ \mathit{\ln}\left({q}_e-{q}_t\right)=\mathit{\ln}{q}_e-{k}_1t $$ (1)其中 q t 为 t 时刻吸附的重金属离子量 (mg g − 1 ), q e 是平衡时吸附的重金属离子的量(mg g − 1 ) 和 k 1 是伪一阶模型常数 (L min − 1 ).
伪二次方程如下:
$$ \frac{t}{q_t}=\frac{1}{k_2{q}_e^2}+\frac{t}{q_e} $$ (2)其中 k 2 是伪二阶模型常数 (g mg − 1 min − 1 ).
粒子内扩散方程如下:
$$ {q}_t={k}_i{t}^{1/2}+C $$ (3)其中 k i 是粒子内扩散模型常数 (mg g − 1 分钟 -1/2 ) 和 C 是扩散常数 (mg g − 1 ).
Elovich模型用于确认化学吸附过程:
$$ {q}_t=\frac{1}{b}\mathit{\ln}(ab)+\frac{1}{b}\mathit{\ln}(t) $$ (4)其中 a 是初始吸附(mg g − 1 ·min − 1 ) 和 b 与化学吸附的表面覆盖程度和活化能(解吸常数)有关(g mg − 1 ).
零电荷点的确定,pHPZC
pHPZC的测定采用漂移法和滴定法。为了测定 pHPZC,将 0.5 g ST-20 样品分散在 100 cm 3 将预先调整到 1 至 14 范围内的预定 pH 值的 0.01 M NaCl 溶液摇晃 1 天,直至达到平衡 pH 值。然后测量每种溶液的pH值。将初始 (pHi) 和平衡 (pHe) pH 值之间的差异与 pHi 作图。
结果与讨论
吸附剂表征
ST20和ST-ALG的质构特征通过氮气吸附/解吸等温线确定。
发现ST20的SBET表面积等于53 m 2 g − 1 (表1)比接近A-50的SBET值(52 m 2 g − 1 )。图 1 显示了 ST-20 和 ST20-ALG 的氮吸附-解吸等温线以及从氮吸附等温线获得的孔径分布 (PSD)。 ST20和ST20-ALG的PSD曲线因聚合物填充氧化物纳米颗粒之间的空隙而不同。
<图片>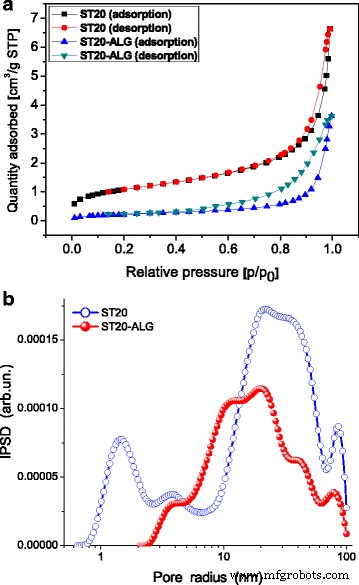
一 77 K 和 b 处的氮吸附-解吸等温线 ST-20 和 ST20-ALG 的增量孔径分布
发现接枝到二氧化硅 A-50 上的二氧化钛的结晶度比单独合成的二氧化钛低得多,这是因为二氧化硅的抑制作用 [40]。海藻酸钠对 ST20 的改性可以改变吸附物向孔隙(空隙)中的扩散,并为进一步的表面改性提供了可能性。因此,这里使用海藻酸钠溶液。另一方面,藻酸盐的机械性能较差,附着力较差。
FTIR 技术,尤其是 ATR 模式,是表征二氧化硅表面的表面官能度(如 Si-OH)的最有效工具之一 [41]。孤立的 Si-OH 基团在 3750 cm − 1 处产生强烈的尖锐带 , 而有机硅化合物中的游离硅烷醇 (Si-OH) 出现在约 3690 cm − 1 用锋利的乐队。在 ATR-FTIR 光谱中,≡SiOH 基团和吸附的水在 3605 cm − 1 处给出了宽的 νOH 谱带 (图2)。
<图片>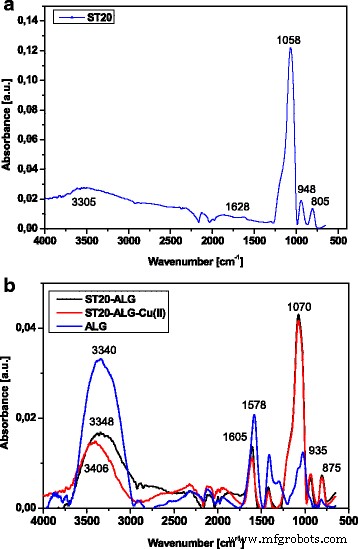
ST20a的FTIR-ATR光谱 之前和b ALG改性和Cu(II)离子吸附后
1058 cm − 1 处的谱带 用于 ST-20 和 1070 用于 ST20-ALG 和 805 cm − 1 归因于二氧化硅。 1067 和 805 cm − 1 处的带 表示不对称和对称的 O-Si 伸缩振动 [42]。 935 cm − 1 处的波段 对应于Si-O-Ti振动,其特征范围为928-952 cm − 1 .在 ST20 上吸附 Cu(II) 和 Pb(II) 后,观察到光谱的变化。烷基已通过煅烧去除,由于 FTIR 光谱中没有 C-H 峰,因此很明显。
ATR-FTIR 光谱与 XRD 和 TEM 结果一致 [40] 表明二氧化钛的颗粒形态对应于结晶锐钛矿。在 ST20 的情况下,二氧化钛颗粒的范围在 15 到 20 nm 之间。当 ST20 由 ALG 改性时,珠子的特征还在于球形形状和平均直径从 0.5 毫米到约 2 毫米不等。从 SEM 图像(图 3)可以看出,形成了覆盖“大脑图案”的 ST20 表面的薄膜,并且可以看到多孔表面。 Cu(II)吸附后,表面被薄片覆盖。
<图片>
ST20-ALG和ST20-ALG-Cu的SEM-EDX分析:比例、放大倍数(mag)、电压(HV)和真空压力如面板所示
pH 影响
pH 值对于不同离子在氧化物表面的吸附起着重要作用。为了确定 pH 值的影响,将样品溶液的 pH 值调整到 2-6 的范围内。所得结果如图 4 所示,表明随着 pH 值从 2 增加到 6,所有研究的金属离子在 ST20-ALG 复合材料上的吸附增加。
<图片>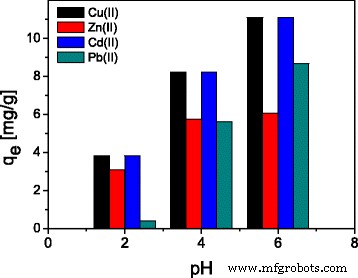
pH值对ST20-ALG吸附Cu(II)、Zn(II)、Cd(II)和Pb(II)的影响
pH 对 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 吸附的影响结果表明,发现 Pb(II) 和 Cd 的定量吸附 (> 95%) (II) 在 pH 值范围 5-6 中,因此初始 pH 值(未经调整,Cu(II) 为 5.5,Zn(II) 为 5.0,Cd(II) 为 5.0,Pb(II) 为 5.0)为作为妥协条件。
同样确定零电荷点,pHPZC 对于理解吸附机制非常重要。 pHPZC 是电解质溶液中固体表面既不带正电荷也不带负电荷时的 pH 值。在 pH 值低于零电荷点的溶液中,吸附剂表面带正电荷,对于 pH 值大于零电荷点的溶液,吸附剂表面带负电荷。众所周知,阳离子吸附发生在高于 pHPZC 的 pH 值,而阴离子在低于 pHPZC 的 pH 值下吸附。发现ST20的pHPZC为7.8,ST20-ALG为8.2。需要说明的是,锐钛矿粉的pHPZC为6.2。
对于TS20,还发现在pHPZC以下,通过离子交换机制发生吸附:
$$ 2\left(\equiv \mathrm{Si}-\mathrm{OH}\right)+{\mathrm{M}}^{2+}\rightleftarrows 2\left(\equiv \mathrm{Si}\mathrm {O}\right)\mathrm{M}+{2\mathrm{H}}^{+} $$ (5) $$ \equiv \mathrm{Si}-\mathrm{OH}+{\mathrm{MOH }}^{+}\rightleftarrows \equiv \mathrm{Si}\mathrm{OMOH}+{\mathrm{H}}^{+} $$ (6)及以上通过键合:
$$ 2\left(\equiv \mathrm{Si}-\mathrm{OH}\right)+\mathrm{M}{\left(\mathrm{OH}\right)}_2\rightleftarrows {\left(\equiv \mathrm{Si}\mathrm{OH}\right)}_2\mathrm{M}{\left(\mathrm{OH}\right)}_2 $$ (7)吸附动力学
时间相接触对 ST20 上 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 吸附的影响如图 5 所示。随着接触时间的增加,吸附容量和吸附百分比 (%S) 最初增加然后达到平衡。 60 分钟后,Cu(II) 和 Zn(II) 离子的吸附达到 80%,然后在 240 分钟后达到 99% 的平台。 Pb(II)在ST20上的快速吸附表明化学吸附占主导地位。
<图片>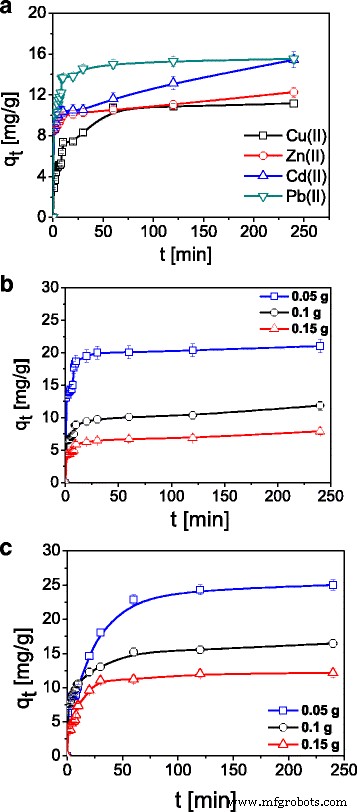
a 的比较 根据时间和 b 吸附在 ST20 上的 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子的量 , c Cu(II)离子对b吸附量的影响 ST20 和 c ST20-ALG (C0 =100 mg L − 1 , m =0.1 克,t =1–240 min, pHCu =5.45, pHZn =5.01, pHCd =5.37, pHPb =5.24, T =293 K, A =7, rpm 180)
如上所述,使用伪一级、伪二级、粒子内扩散和 Elovich 模型确定了 ST20 上 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 的动力学。表 2 列出了 ST20 上 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 吸附的动力学模型参数。 ST20-ALG 的类似结果列于表 3 中。拟合结果也在图 6 中给出。伪一阶模型仅适用于吸附过程发生非常迅速的情况,因此在我们的研究中它没有给出理想的结果。 ST20 上每种金属离子的伪二级动力学模型提供了最佳拟合(R 2 > 0.999)。这表明吸附过程中的速率控制步骤是化学吸附。
<图片>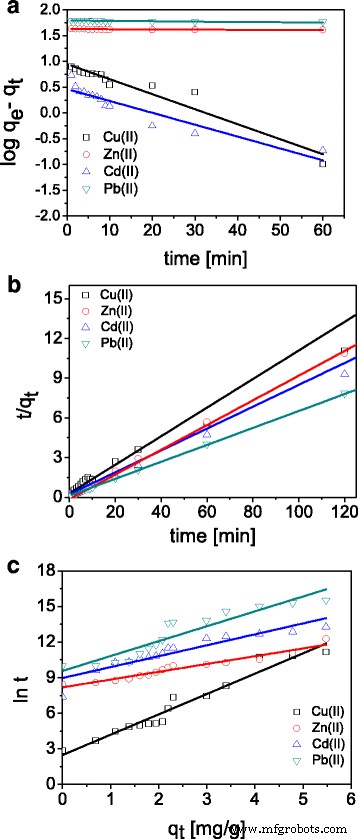
Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子在 ST20 a 上的吸附动力学图 伪一阶模型,b 伪二阶模型和 c 埃洛维奇模型
在基于q图的粒子内扩散模型的情况下 t 与 t 1/2 ,可以区分三个吸附阶段的多重线性(数据未提供)。众所周知,当绘图通过原点时,只有粒子内扩散是限速步骤。结果表明,曲线没有通过原点,这表明吸附过程不是唯一的速率控制步骤。第一步与金属离子从溶液扩散到 ST20 外表面或溶质分子的边界层扩散有关。在 Cd(II) 或 Pb(II) 的情况下,第一步是快速的。第二阶段表明由于粒子内扩散,金属离子进入了 ST20 的孔中。第三阶段受扩散到小孔的影响。由于达到最大吸附,颗粒内扩散结束。此外,发现得到的直线不通过原点,并且PFO和PSO的相关系数低于这些,因此该模型不适合解释研究过程的性质。
对于 Elovich 模型,参数 (1 /b ) 和 (1 /b )ln(ab ) 从 q 的线性图的斜率和截距获得 t vs. ln t 也列在表 2 和表 3 中。 1 的值 /b 表示可吸附的位点数,而 (1 /b )ln(ab ) 为 lnt 时的吸附量 等于零。该值有助于理解吸附行为。 ST20的所有金属离子的相关系数为0.8926-0.9494,ST20-ALG的相关系数为0.8688-0.9516,表明该模型不适用于ST20上的金属离子吸附。
吸附等温线
最常用的等温线模型仍然是 Langmuir 和 Freundlich 模型。 Langmuir 模型 (LM) 基于均匀吸附位点和吸附组分之间不存在相互作用的假设。 Langmuir方程的非线性形式为:
$$ {q}_e=\frac{q_0{K}_L{c}_e}{1+{K}_L{c}_e} $$ (8)其中 q 0 为最大吸附容量(mg g − 1 ) 和 K L为吸附能(L/mg)。
Freundlich 模型 (FM) 是经验假设,假设吸附剂表面异质且吸附物的吸附容量呈指数增长:
$$ {q}_e={K}_F{c}_e^{1/n} $$ (9)其中 K F 是 Freundlich 模型的吸附容量特征 (mg g − 1 ) 和 1 /n 是与表面异质性相关的弗氏常数。
参数 K F 和 n 基于线性关系logc计算 e 对比 logq e .此外,1 /n 值表示不可逆的等温线类型 (1/n =0), 有利 (0 <1/n <1) 和不利 (1/n> 1).
此外,选择 Dubinin-Radushkevich (D-RM) 等温线模型来建立 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子吸附在 ST20 和 ST20-ALG 上的吸附机制。它可以用来描述在均质和异质表面上的吸附:
$$ {q}_e={K}_{DR}{\exp}^{-{\beta \varepsilon}^2} $$ (10)其中 q e 是理论等温线容量 (mg g − 1 ), K DR 是与每摩尔吸附质的平均吸附自由能相关的常数 (mol 2 J − 2 ), 和 ε 是波兰尼势。 Polanyi势可以表示为:
$$ \varepsilon =RTln\left(1+\frac{1}{c_e}\right) $$ (11)其中 R 是气体常数 (8.314 J mol − 1 K − 1 ), T 是温度 (K),c e 是平衡时的浓度 (mg L − 1 ) [36,37,38]。
在研究的第一阶段,证明吸附在 ST20 和 ST20-ALG 上的金属离子的量随着初始浓度的增加而增加。示例性结果和 Cu(II) 离子吸附初始浓度对 ST20 的影响如图 7 所示。
<图片>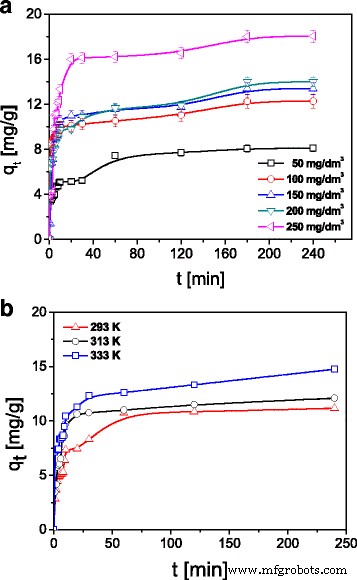
根据a吸附Cu(II)离子的量比较 专注于 ST20 和 b ST20 上的温度 (C0 =50, 100, 150, 200, 250 mg/L, m =0.1 克,t =1–180 分钟,pHCu =5.45,T =293 K, A =7, rpm 180)
通过检查 c 的关系获得了所研究的 ST20 和 ST20-ALG 吸附剂上 Cu(II)、Zn(II)、Cd(II) 和 Pb(II) 离子的平衡等温线 e /q e 对比 c e 在 LM 的情况下,logq e 对比 logc e 在 FM 的情况下,lnq e 与 ε 2 在 D-RM 的情况下。 模型拟合结果如表4所示。
Langmuir 等温线模型给出了最高的相关系数值,表明该模型更好地描述了 ST20 和 ST20-ALG 上重金属离子的吸附(图 8)。因此单层的形成比异质表面吸附更可能。此外,Langmuir 等温线假设表面吸附能量均匀,吸附分子之间不存在相互作用。
<图片>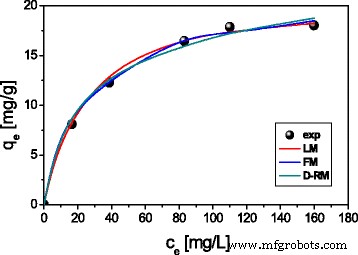
在 ST20 上 Cu(II) 的 Langmuir (LM)、Freundlich (FM) 和 Dubinin-Radushkevich (D-RM) 等温线 (C0 =50–250 mg L − 1 , m =0.1 克,t =180 分钟,pHCu =5.45,T =293 K, A =7, rpm 180)
Cu(II) 22.44 mg g − 1 的最大吸附容量 , 对于 Zn(II) 19.95 mg g − 1 , 对于 Cd(II) 18.85 mg g − 1 , 对于 Pb(II) 32.49 mg g − 1 were obtained at an initial metal concentration in the range 50–250 mg L − 1 , pH 5, ST20-ALG dose 1 g/L, and the phase contact time 240 min. For ST20 sorbent, they were a bit lower and equal to 20.26, 17.63, 16.73, and 26.89 mg g − 1 , 分别。 Conversion of the maximum sorption capacities values into mmol g − 1 allows comparison of the number of adsorbed cations Cu(II), Zn(II), Cd(II), and Pb(II). These values show that the amount of adsorbed metal ions decreases in a sequence corresponding to an increase in their atomic weights:63Cu (0.35 mmol g − 1 for ST20-ALG and 0.31 mmol g − 1 ST20) > 65Zn (0.31 mmol g − 1 for ST20-ALG and 0.27 mmol g − 1 for ST20) > 112Cd (0.17 mmol g − 1 for ST20-ALG and 0.15 mmol g − 1 ST20) > 207Pb (0.16 mmol g − 1 for ST20-ALG and 0.13 mmol g − 1 for ST20). Such a sequence contradicts the regularities of ions adsorption by their position in the lyotropic series (the Hoffmeister series) implying the formation of a hydrated shell around the cations inversely depends on their radii and, accordingly, the adsorption of ions of the same valence should increase as their radii increase because of the hydration shell decrease and an ion polarity increase. The violation of this regularity can be explained by the higher affinity of such ions as Cu(II) and Zn(II) to the surface of adsorbents at very close atomic radii sizes.
Coexisting Anions Effect
When studying the phenomena of cations adsorption, it is necessary to take into account the electrolyte composition of the solution, since coexisting anions depending on their species can either promote cation adsorption or reduce it. Such influence significantly contributes to the study of the pattern of adsorption of cations, therefore the effects of coexisting ions Cl − and NO3 − at the concentration of 100 mg L − 1 on the adsorption of Cu(II), Zn(II), Cd(II), and Pb(II) on ST20-ALG were also investigated. In these experiments, the solutions of 100 mg L − 1 Cu(II) containing the added interfering ions were shaken with ST20-ALG for 240 min. It can be seen that when adsorbing various cations, the coexisting Cl − and NO3 − anions have different effects (Fig. 9).
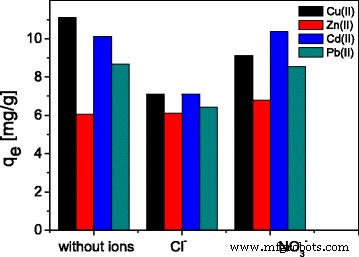
Coexisting ions effect on the sorption of Cu(II), Zn(II), Cd(II), and Pb(II) on ST20-ALG
Thus, in the case of the Zn(II) adsorption, the addition of Cl − and NO3 − does not change the maximum adsorption value. During Cu(II) adsorption, the presence of both of anions decreases adsorption capacity, although in varying degrees:the effect of NO3 − is relatively minor, but influence of Cl − is very noticeable. The effect of NO3 − on adsorption of Cd(II) and Pb(II) is absent, whereas in the presence of Cl − , the adsorption capacity decreases noticeably. Such regularities show the complexity of the cations adsorption process on the surface of adsorbents, and the need for taking into account such factors as the presence and concentration of indifferent and non-indifferent electrolytes affecting processes by both changing the surface charge of adsorbents and the structure of the double electric layer formation, as well as influence on the diffusion process.
结论
The successful application of nanosized TiO2-based sorbents such as ST20 and ST20-ALG for heavy metal ions removal from waters and wastewaters was proved. In this study, the adsorption of heavy metal ions such as Cu(II), Zn(II), Cd(II), and Pb(II) on ST20 and ST20-ALG sorbents was studied. Additionally, the modification of oxide silica-titania composite with alginate as a very simple and cheap method for prevention of aggregation of nanosized TiO2-SiO2 particles was confirmed. ST20 modification is a rapid method for intensification of its adsorption properties. Cu(II), Zn(II), Cd(II), and Pb(II) ions sorption is predominantly affected by a combination of factors, namely the initial metal concentration, pH, sorbent dosage, and the phase contact time. The study indicates that the heavy metal ions such as Cu(II), Zn(II), Cd(II), and Pb(II) exhibit the high affinity for ST20-ALG as well as for ST20.
The Langmuir isotherm model gave the highest correlation coefficient values, showing that during the heavy metal ions adsorption on ST20 and ST20-ALG, the monolayer formation is more presumable than heterogeneous surface sorption. The observed equilibrium values of maximum adsorption of all studied metal ions are higher for the organo-inorganic ST20-ALG composite than for the ST20 oxide.
The study of adsorption kinetics has shown that with the increasing contact time, the adsorption increase dramatically in the first 10 min, reaches 80% in 60 min, and then reaches the equilibrium plateau of 99% in 240 min. Comparison of different models for the interpretation of kinetic adsorption data has shown that the most adequate model for both types of adsorbents (inorganic ST20 and organo-inorganic ST20-ALG) is the pseudo second order kinetic model for each metal ion on ST20 affords the best fitting (R 2 > 0.9990). This indicates that the rate controlling step in the adsorption process is the chemisorption one. In addition, the analysis of kinetic data using the intraparticle diffusion model showed the effect not only of the adsorption process itself but also diffusion of metal ions from solution to the outer surface and penetration into the pores of the adsorbent on the adsorption rate.
The effects of coexisting ions Cl − and NO3 − are different for the sorption of the studied metal ions. Thus, Сu(II) adsorption decreases in the presence of both of coexisting ions Cl − and NO3 − , NO3 − ions does not have any effect on sorption of Cd(II) and Pb(II), while the presence of Cl − ions reduces adsorption, and the effect of coexisting ions is absent for Zn(II) sorption.
缩写
- ATR:
-
Attenuated total reflectance
- D-RM:
-
Dubinin–Radushkevich isotherm model
- EM:
-
Elovich kinetic model
- 调频:
-
Freundlich isotherm model
- FTIR:
-
Infrared spectroscopy
- IPD:
-
Intraparticle diffusion model
- LM:
-
Langmuir isotherm model
- PFO:
-
Pseudo first order model
- PSO:
-
Pseudo second order
- S BET :
-
Specific surface area
- SEM:
-
扫描电镜
纳米材料
- 二氧化硅气凝胶负载的水锌矿和碳酸盐插层水滑石通过沉淀转化反应高效去除 Pb(II) 离子
- 改性超支化聚甘油作为分散剂,用于控制和稳定碳氢化合物中的金纳米粒子
- 通过金属盐-聚合物纳米复合膜的相分离形成的表面纳米结构,用于抗反射和超疏水应用
- 用 Au 纳米粒子定制的二氧化硅硅藻壳可以对用于生物、安全和环境应用的分子进行灵敏分析
- 通过海藻酸钠电解质-磺化氧化石墨烯生物膜增强质子电导率和降低甲醇渗透率
- 如何最大限度地提高重型建筑和农用设备的燃油效率
- 20 种适合初学者的基本焊接工具和设备
- 使用金属润滑剂的技巧:避免过度润滑等
- 冶金术语解释:制造商和机械师术语表
- 重型设备定期维护和更换电池的好处
- 使用重型设备进行拆除和解构的指南
- 燃油喷射系统金属零件的制造和加工


