石墨烯和氧化石墨烯的体外和体内生物安全和抗菌能力
摘要
近年来,石墨烯(G)和氧化石墨烯(GO)纳米颗粒开始应用于外科植入物表面改性。然而,G和GO的生物安全性和抗菌能力尚不清楚。在本研究中,通过与骨髓间充质干细胞 (BMSCs) 共培养评估 G 和 GO 的体外生物安全性,并通过将材料植入小鼠肌肉组织观察体内生物安全性。生物安全结果表明,10 μg/ml 是 G 和 GO 的安全临界浓度。当浓度超过10 μg/ml时,G和GO的细胞毒性呈剂量依赖性。
抑菌结果表明,G在浓度≥100 μg/ml时表现出抗菌能力; GO在浓度等于和大于50μg/ml时表现出抗菌能力。 G和GO的体外抗菌作用呈剂量依赖性。
50 和 100 μg/ml 之间的 GO 或 G 浓度可能是保持细胞毒性和抗菌能力平衡的更好范围。我们的研究表明,G和GO在一定浓度范围内具有良好的生物安全性和抗菌性能,具有临床应用潜力。
背景
近年来,外科植入物被广泛用于治疗骨折等疾病,但植入物需要良好的生物安全性和抗菌性能,以避免排斥和感染。事实上,感染性骨缺损的骨科治疗仍是一大难题。在细菌方面,金黄色葡萄球菌 是骨科和骨科植入物中最常见的病原体[1]。由于骨缺损和感染[2],治疗困难,患者需要很长时间才能痊愈。如果伤口不愈合,最后的治疗是截肢[3, 4]。
感染性骨缺损的良好治疗应同时满足感染控制和重建骨缺损修复的要求。随着骨组织工程的发展,越来越多的生物材料应用在骨科治疗领域。因此,可以大大提高骨骼感染的治愈率。这些材料主要包括异质骨[5]、生物陶瓷[6](如羟基磷灰石[7]和磷酸钙[8])、聚合物[9、10]、蛋白质材料(如胶原纤维[11])、等等。除了这些材料,Beatriz Pelaz 等人。揭示了纳米技术在植入物中的重要性和前景[12];在这些纳米粒子中,石墨烯及其衍生物是满足骨修复要求的其他新型材料。
石墨烯是二维的,在蜂窝结构中具有单层或几层碳原子 [13,14,15]。由于其优异的物理性能,它被广泛应用于复合材料[16, 17]、传感器[18, 19]、能源[16, 20]等领域。氧化石墨烯是一种表面功能化的石墨烯材料,它在一层碳原子上与含有氧的基础表面活性基团的二维无限延伸相连,其氧化石墨烯的形式[21]。石墨烯(G)及其衍生物由于其独特的二维结构以及特定的物理化学性质而在生物医学领域引起了极大的关注[22]。功能化石墨烯及其衍生物具有载药[23]、抗菌[24]、生物成像[25, 26]、癌症治疗[27]等多种功能。
在抗菌能力方面,Li 等人。揭示 G 抗菌机制主要是由电荷转移 [28] 和细菌迁移引起的。细菌转移到锋利的纳米片表面,通过锋利的边缘撕裂细菌 [29]。此外,Tu 等人。还证明了另一种潜在的抗菌机制,即 G 可以渗透到细胞中,导致从细胞膜中提取大量磷脂 [30]。因此,G和氧化石墨烯(GO)具有生物活性和抗菌能力,符合骨修复材料的要求。
然而,随着规模化生产和应用,石墨烯的生物安全问题尤为重要。工人可能会通过多种介质接触纳米颗粒 (NPs),包括吸入、皮肤接触和胃肠道。安德里亚普罗迪等。建议采用逐步方法来评估 NP 暴露以进一步保护 [31]。除评估外,生物安全性和生物相容性是其他研究重点。王侃等。证明了GO的生物相容性,当剂量小于20μg/ml时对人成纤维细胞表现出毒性,但当剂量超过50μg/ml时表现出明显的细胞毒性,细胞粘附显着降低[32]。目前,更一致的观点证实 G 和 GO 对细菌有毒性作用,但对细胞有毒性作用 [33,34,35,36]。 G和GO的功能和毒性还需要更具体的研究。比阿特丽斯·佩拉兹 (Beatriz Pelaz) 等人。提出了一个问题,“如何降低风险和增加收益对于开发安全有效的纳米药物至关重要”,这提醒和敦促研究将G和GO的潜在风险和体内体外抗菌能力结合起来[12] .
骨髓间充质干细胞 (BMSC) 是多能成体干细胞。它们已成为组织工程中修复骨缺损的重要细胞来源 [37, 38]。此外,石墨烯及其衍生物与干细胞之间的相互作用尚缺乏研究[39, 40]。
因此,本研究在体外小鼠肌肉组织金黄色葡萄球菌中研究了G和GO对BMSCs的影响。 ,旨在研究G和GO在体内外的细胞毒性和抗菌能力,促进碳纳米材料纳米药物和纳米毒性的研究。
结果
G 和 GO 细胞毒性
G 和 GO 体外细胞毒性
在电子显微镜下,G或GO纳米颗粒呈不规则形状,尺寸为30.41±5.59 nm,并且可以发现颗粒团聚(图1a,b)。培养7天后,细胞形态变为纺锤形(图1c)。用成骨分化培养基培养后形成钙结节(图1d)。成脂分化后形成油藏(图1e)。
<图片>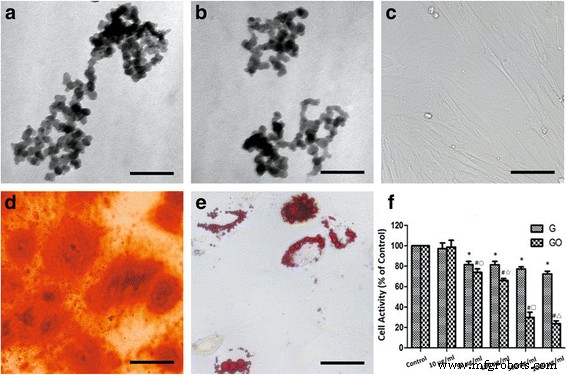
G 和 GO 细胞毒性 (a , b). G (a ) 和 GO (b ) 显示形成的纳米网络。 c BMSCs 的细胞形态学。 d 茜素红用于钙沉积。 e 油红O为脂质。 f G和GO处理后的细胞活性,*P <0.01 与对照组, # P <0.01 与对照组, ○ P <0.05 with G 50 μg/ml 组, ☆、□、△ P <0.01 与相同浓度的 G 组。 r 2 (G) =0.843, r 2 (GO) =0.939。比例尺a , b 200 纳米,c , d 100 微米,e 50 微米。 r , 相关系数
当浓度高于 10 μg/ml 时,G 或 GO 抑制 BMSCs 的生长。 1000 μg/ml组细胞毒性最高,呈剂量依赖性。当浓度高于10 μg/ml时,相同浓度下GO组的细胞毒性高于G组。随着浓度的增加,差异更显着(图1f)。
在SEM观察下,当G或GO浓度为10 μg/ml时,BMSCs状态良好,附着力和形态良好。当 G 浓度超过 50 μg/ml 时,发现细胞发生变化,包括大小减小、表面分泌增加和细胞表面微绒毛延伸。当 GO 浓度超过 50 μg/ml 时,骨髓间充质干细胞出现萎缩变形,大部分细胞死亡。这些结果表明,在相同浓度下,GO对BMSCs的细胞毒性高于G(图2)。
<图片>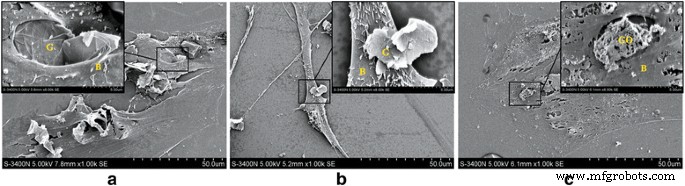
G、GO 和 BMSC 共培养的 SEM 图像。 一 G组,10微克/毫升。细胞状况良好。 b G组,50微克/毫升。细胞体积减小,表面分泌增加,细胞表面微绒毛变长。 c GO 组,50 μg/ml。 BMSC 收缩和变形。 G石墨烯、GO氧化石墨烯、B BMSCs
在TEM观察下,我们发现G或GO可以进入BMSC并沉积在细胞内部。当浓度超过50 μg/ml时,细胞微环境发生变化,包括细胞结构紊乱,微绒毛混乱,表明GO的细胞毒性高于G组(图3)。
<图片>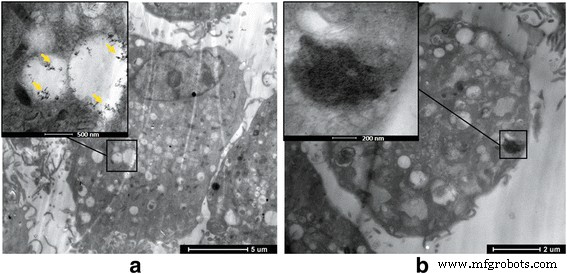
G、GO 和 BMSC 共培养的 TEM 图像。 一 G团。 b 去组。 G和GO均可导致细胞结构紊乱和细胞表面微绒毛混乱; GO引起高细胞毒性细胞微环境变化
根据 SEM 和 TEM 观察结果,我们发现 10 μg/ml 是 G 和 GO 的安全临界浓度。当GO浓度大于10 μg/ml时,GO对BMSCs的细胞毒性高于G。
G 和 GO 体内细胞毒性
为了分析体内 G 和 GO 细胞毒性,我们选择骨骼组织来代表和模拟骨科中的局部移植情况。对照组和G组骨骼组织HE染色结果呈正常结构,肌原纤维平行于纵轴。横切面肌原纤维断面呈细点状,细胞核位于细胞边缘。上述变化也可在正常骨骼细胞中发现,说明G对肌肉组织的毒性很小。
相反,GO组纵切面肌纤维横线断裂且不清晰,可见肌肉萎缩坏死。因此,GO对动物具有较高的毒性(图4)。
<图片>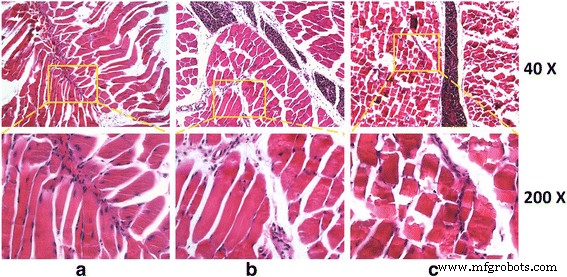
组织切片用 HE 染色。 一 对照代表未受伤的组织。 b G团。骨骼细胞呈直条状。肌肉肌原纤维沿长轴平行,横线清晰,断面呈不规则块状。肌原纤维部分表现为细点;核位于边缘。 c 去组。纵切面肌纤维横线断裂,不清晰
G 和 GO 抗菌特性
体外抗菌能力
在体外抑菌实验中,G或GO的ROI光子强度呈剂量依赖性。并且光子强度随着浓度的增加而降低。与相同浓度的G组相比,GO组的光子强度较低(图5)。
<图片>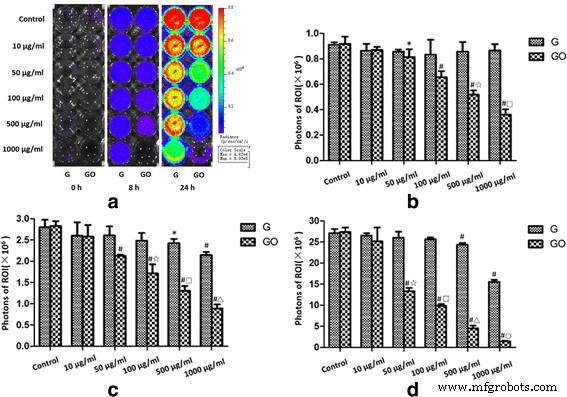
S生物发光强度监测 . 金黄色葡萄球菌 体外。 G和GO在体外抗菌能力方面表现出剂量依赖性。 一 Xen-29 的生物发光在 37 °C 下孵育 0、8 和 24 小时后在体外成像,颜色变化代表光强度(Bin M(8)、FOV12、f1、15 s)。 b PI =0 小时,r 2 (GO-0 小时) =0.924。 c PI =8 小时,r 2 (G-8 h) =0.584, r 2 (GO-8 小时) =0.960。 d PI =24 小时,r 2 (G-24 h) =0.616, r 2 (GO-24 小时) =0.943.*P <0.01 与对照组, # P <0.01 与对照组, ☆、□、△、○ P <0.01 与相同浓度的 G 组。 r , 相关系数
在0、8和24小时,当G浓度分别为100、500和1000 μg/ml时,与对照组相比,G显示出对Xen-29生长的抑制能力。而10、50 μg/ml组的光子强度与对照组相比无显着差异。
当GO浓度为50、100、500和1000 μg/ml时,在0、8和24小时,GO显示出对Xen-29的生长抑制作用。同理,10、50 μg/ml组光子强度与对照组相比差异无统计学意义。
结果表明,G在浓度大于100 μg/ml时表现出抗菌能力,GO在浓度大于50 μg/ml时表现出抗菌能力。 G或GO的抗菌能力呈剂量依赖性。 GO在相同浓度下的抗菌能力较G强。
体内抗菌能力
在体内抑菌实验中,GO组在0和24小时显示出显着较低的光子强度(PI)值。 PI值较G组和对照组降低。然而,与对照组相比,G 组的 PI 值没有统计学上的显着差异(图 6)。结果表明,GO在100-μg/ml浓度下显示出较强的抗菌能力,而G在体内无明显抗菌能力。
<图片>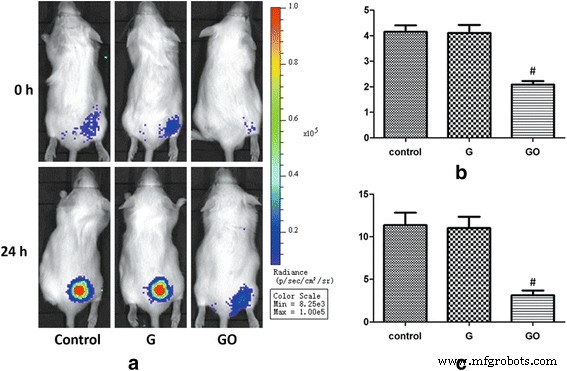
S生物发光强度监测 . 金黄色葡萄球菌 体内。 GO 在体内的抗菌能力显示出剂量依赖性方式。 一 Xen-29 的生物发光在孵化 0 和 24 小时后在体内成像,颜色的变化代表光强度(Bin M(8)、FOV12、f1、60 s)。 b PI =0 小时, # P <0.01 与对照组。 c PI =24 小时, # P <0.01 与对照组
讨论
随着组织工程的发展,越来越多的生物材料应用在骨科治疗领域[41]。生物材料需要良好的生物安全性。 G和GO因其安全性和独特的理化性质在医学领域得到广泛应用。在抗菌能力方面,G和GO是较好的抗菌物质。主要的抗菌机制是电荷转移 [28, 29] 和渗透到细胞中 [30]。因此,G和GO的抗菌能力在安全范围内可以满足骨修复材料的要求。
在这项研究中,为了确定生物安全特性,我们通过 SEM 和 TEM 观察到 G 和 GO 对 BMSC 的细胞毒性作用,这种作用表现为剂量依赖性。此外,GO具有更高的细胞毒作用。在抗菌性能方面,我们进一步观察到 G 和 GO 具有剂量依赖性的抗菌性能,在体内 GO 效果明显优于 G。综上所述,50~100 μg/ml的浓度范围可能会更好地保持微毒作用和主要抗菌能力的平衡。
本研究表明G和GO均对BMSCs和骨骼细胞具有细胞毒作用,GO毒性高于G。大量研究证明了G纳米细胞毒性及其材料的理化性质(如大小、形状和表面官能团)对细胞 [35, 42, 43]。此外,研究人员发现原始 G 可以通过线粒体膜电位 (MMP) 的消耗和细胞内活性氧 (ROS) 的增加来诱导细胞毒性 [12],从而通过激活线粒体途径引发细胞凋亡 [34, 44] .但GO的细胞毒性高于G的现象可能与GO表面所含的基团有关[45]。研究人员发现,GO 的细胞毒性与血清含量直接相关。胡伟等。证明GO具有很强的吸附能力,可以吸附血清蛋白形成蛋白质包裹体[46],证明与G相比,GO具有更高的细胞毒性碱性。我们的实验证实了上述结论。此外,动物毒性是评价G和GO生物安全性的另一个重要指标。本研究发现GO组肌肉组织出现严重病理反应,表明其毒性高于G组。
其次,抗菌性能符合G和GO剂量变化; 50~100 μg/ml GO浓度可以更好地平衡生物毒性和抗菌能力。我们的研究表明,生物毒性和抗菌能力均以剂量依赖性方式存在。因此,在一定的浓度范围内,可以保持微生物毒性和主要抗菌能力的平衡。
结果表明,G和GO均对BMSCs和肌肉组织有一定的生物毒性,但GO组在体内抗菌能力显着。基于之前的G和GO毒性结果,我们发现50~100 μg/ml的浓度可能是保持轻微生物毒性和主要抗菌能力平衡的较好浓度,从而为生物安全和抗菌提供了新的证据。 G和GO在体内外在临床工作中的作用。
尽管 GO 具有很大的毒性作用,但可以通过修饰 GO 来避免毒性 [47, 48]。同时,修饰的GO材料可以在体内降解和清除[49];因此,迫切需要一个新的GO修饰研究方向。此外,G和GO对其他重要器官或组织的影响仍需要进一步研究以达到整体医学。同时,GO是否对细菌造成氧化应激损伤以及是否存在额外的抗菌机制需要进一步研究。在应用于组织工程之前,G和GO的毒性机制以及降低毒性的改进方法还需要更多的阐明。
方法
动物
雄性 Sprague-Dawley (SD) 大鼠和雄性 Balb/C 小鼠购自伊朗巴斯德研究所,并在 25°C 的 12 小时光照/黑暗条件下维持。 4周龄的SD大鼠用于BMSCs的分离。 Balb/C 小鼠用于体内动物实验。所有动物均在第四军医大学实验动物中心饲养,按照西京医院动物实验外科标准操作。所有动物实验均经第四军医大学动物护理与使用机构委员会批准。
石墨烯和氧化石墨烯
将 G 或 GO(1-2 层)(中国恒秋石墨烯科技有限公司)分别加入无水乙醇(用于透射电子显微镜测试,TEM)、PBS 缓冲液(用于体外细胞实验)和盐水溶液(用于体内动物实验)制备G或GO溶液(拉曼光谱测试结果由恒秋石墨烯科技提供)。 G 或 GO 溶液的初始浓度为 1 mg/ml。实验前2 h用超声波分散G或GO溶液。
细胞毒性
细胞培养
细胞培养基含有 10% 胎牛血清 (Gibco, Carlsbad, California, USA)、DMEM/F12 (Corning, NY, USA)、100 U/ml 青霉素和 100 U/ml 链霉素 (Sigma, St. Louis,美国密苏里州)。采用骨髓培养法从4周龄雄性大鼠中提取BMSCs[50]。大鼠处决后,在无菌条件下取出股骨和胫骨。髓腔用细胞培养基洗涤;然后,将混合物在 1500 rpm 下离心 10 分钟以收集骨髓。骨髓用细胞培养基重悬,接种于明胶包被的细胞培养瓶中,37℃,5%二氧化碳细胞培养箱。 48小时后更换细胞培养瓶中的培养基,去除非贴壁细胞;然后每48小时更换一次培养基。第三至第五代细胞用于下一步实验。
用分化培养基(Cyagen,CA,USA)对 BMSC 进行成骨分化和成脂分化。分化诱导2周后,用4%甲醛溶液固定细胞30分钟;然后进行成骨分化的茜素红染色和成脂分化的油红染色。
细胞活动
BMSC悬液浓度调整为5×l0 4 /l,细胞在 96 孔板中培养,每孔 100 μl。 24小时后,将培养基更换为含有G或GO的细胞培养基,浓度为0(作为对照组)、10、50、100、500和1000 μg/ml。培养 24 小时后,将 10 μl alamarBlue(Bio-rad,Hercules,CA,USA)加入每个孔中,继续培养 4 小时。微孔板(Bio-rad,Hercules,CA,USA)用于检测 570 和 600 nm 处的 OD(光密度)值,然后使用 alamarBlue® 比色计算器(Bio-rad,Hercules,California,USA)检测评价细胞增殖率。
使用 SEM 进行表征
BMSCs 接种在 24 孔薄玻璃板中,厚度为 0.17 mm,直径为 14 mm。培养24 h后,更换为含有G或GO的细胞培养基,浓度为0(作为对照组)、10、50、100、500和1000 μg/ml。细胞继续培养24小时,然后去除上清液。细胞用 2.5% 戊二醛溶液固定 24 h。脱水烫金后,用扫描电子显微镜(Hitachi S-4800 SEM,JPN)观察细胞。
使用 TEM 进行表征
G 和 GO 悬浮液调整为 50 μg/ml。细胞与 G 或 GO 共培养 24 小时,然后用 0.25% 胰蛋白酶消化。以 1000 rpm 离心 10 分钟后去除上清液。细胞用2.5%戊二醛溶液固定24 h,透射电镜(FEI Tecnai G2 TEM,美国)观察切片。
肌肉组织的毒性和鉴定
为了分析体内 G 和 GO 细胞毒性,我们选择骨骼组织来代表和模拟骨科中的局部移植情况。 G或GO分别注射到Balb/C小鼠的股骨内侧肌肉组织中。 7天后处死小鼠,注射G或GO的肌肉组织用10%中性甲醛溶液固定24小时。酒精脱水后,将组织用石蜡包裹并切片进行苏木精伊红(HE)染色。切片在倒置显微镜(Leica DMI6000B倒置显微镜,RBT)下观察。
抗菌能力
细菌培养
我们选择 Xen-29 来培养它的发光反应。 Xen-29是金黄色葡萄球菌的一种生物发光细菌 (Caliper, LS, USA) 源自 ATCC-12600。细菌在含有 200 μg/ml 卡那霉素(Sigma,St. Louis,MO,USA)的 Luria Bertani 培养基(LB,Sigma,St. Louis,MO,USA)中在 37°C 下培养。在 37°C 的 LB 肉汤中以 200 rpm 的速度摇动 2-3 小时,取单菌落。当600 nm处的吸光度与LB肉汤空白的吸光度相比达到0.5(约等于1.44×108 cfu/ml)时,该菌用于下一步实验。
生物发光成像
为了呈现生物发光成像,我们使用了 IVIS Lumina II 冷却 CCD 光学宏观成像系统(Caliper,LS,USA)。细菌生物发光信号被转换成光子强度(PI)。 Living Image® 4.2 软件(Caliper, LS, USA)用于量化感兴趣区域 (ROI) 中的 PI。为防止成像过程中小鼠移动,对小鼠进行麻醉,避免接收信号不稳定。
体外抗菌能力
24孔板中加入Xen-29,每孔浓度为10 7 cfu。然后,加入 G 或 GO 悬浮液将浓度调整为 0(对照)、10、50、100、500 和 1000 μg/ml。每个孔中的恒定体积为 500 μl。为了分析G和GO的抗菌能力,在干预后0、8和24小时依次测量ROI中的细菌PI。
体内抗菌能力
根据以上实验结果,选择100 μg/ml组进行抗菌能力鉴定。将 Xen-29 悬浮液(200 μl)注射到 Balb/C 小鼠的股骨内侧肌肉组织中。术后0h和24h检测ROI的PI。
数据分析
所有数据均表示为平均值±标准偏差(SD)。学生的t 测试用于比较相同浓度的G和GO。使用单向方差分析(ANOVA)分别比较不同浓度下 G 和 GO 之间的差异。 P <0.05 被认为具有统计学意义。
结论
总之,G和GO具有一定的剂量依赖性的生物细胞毒作用。 G 和 GO 具有抗菌特性,也具有剂量依赖性功能; GO 在体内的抗菌性能明显优于 G。 50~100 μg/ml的浓度可能更好地保持较小的生物毒性和较大的抗菌能力的平衡。此外,需要阐明GO修饰以降低毒性,以促进G和GO在纳米医学中的应用。
缩写
- BMSCs:
-
骨髓间充质干细胞
- G:
-
石墨烯
- 开始:
-
氧化石墨烯
- 他:
-
苏木精和伊红
- LB:
-
Luria Bertani 培养基
- NP:
-
纳米粒子
- PI:
-
光子强度
- ROS:
-
活性氧
- SEM:
-
扫描电子显微镜
- TEM:
-
透射电子显微镜
纳米材料
- 扬声器和耳机中的石墨烯
- 氧化铜纳米颗粒对大肠杆菌的生物合成、表征和抗菌潜力评估
- 用于超级电容器应用的石墨烯和聚合物复合材料:综述
- 钛酸盐纳米管装饰氧化石墨烯纳米复合材料:制备、阻燃和光降解
- 石墨烯和氧化石墨烯的体外和体内生物安全和抗菌能力
- 石墨烯/WO3 和石墨烯/CeO x 结构作为超级电容器应用电极的评估
- 纳米级 CL-20/氧化石墨烯的一步球磨制备显着降低粒径和灵敏度
- 通过腹膜内和静脉内给药途径对大鼠生物合成铜和氧化锌纳米颗粒的体内比较检查
- 通过海藻酸钠电解质-磺化氧化石墨烯生物膜增强质子电导率和降低甲醇渗透率
- 氧化锌纳米粒子的特性及其对微生物的活性
- 氧化石墨烯的低温还原:电导率和扫描开尔文探针力显微镜
- 无配体铱纳米粒子的简便合成及其体外生物相容性


