使用 5-氟尿嘧啶作为抗癌药物递送系统的牛磺酸功能化氧化石墨烯的制备和表征
摘要
最近,用于癌症药物的纳米载体系统,尤其是基于 GO 的药物递送系统,已成为癌症患者的福音。在这项研究中,我们选择 Tau 来功能化 GO 表面以提高其生物相容性。首先,采用改进的 Hummer 法和超声剥离法合成了纳米级 GO。采用化学方法合成牛磺酸修饰的氧化石墨烯载体(Tau-GO),得到在水中具有良好分散性和稳定性的Tau-GO,其zeta电位为 - 38.8 mV,粒径为242 nm。基于包封效率评估标准,确定了通过非共价键结合 Tau-GO 和 5-FU 的最佳配方。 5-FU-Tau-GO在中性环境中比在酸性环境中更稳定,并具有一定的PH响应和缓释作用。在体内,我们分别使用药代动力学测试和相关参数比较了 5-FU 和 5-FU-Tau-GO 的口服和静脉给药,结果表明 5-FU-Tau-GO 口服或静脉给药延长了 5 -FU 在体内并提高其生物利用度。此外,MTT法测定对HepG2细胞的抑制作用表明,5-FU的IC50值为196 ± 8.73 μg/mL,5-FU-Tau-GO的IC50值为65.2 ± 0.7 μg /mL,表明5-FU-Tau-GO对HepG2细胞的作用更强,对癌细胞的抑制作用更强。使用 AO/EB 染色测量的对细胞形态的影响还表明,与 5-FU 相比,5-FU-Tau-GO 不仅破坏细胞,而且显着诱导细胞凋亡。我们还通过计算机辅助设计验证了 Tau-GO 与 5-FU 的结合比未修饰的 GO 更好,形成的 5-FU-Tau-GO 系统更稳定,有利于 5-FU 的转移和释放。体内FU。
介绍
化疗仍然是治疗各种癌症的常用方法[1]。大多数化疗药物的一个显着障碍是它们无法以有效浓度穿透肿瘤组织,或者它们对正常组织产生不希望的副作用 [2]。因此,科学家们集中精力开发一种有效的药物递送系统,可以实现药物在肿瘤组织中的可控释放,以确保有效的药物递送和治疗。
许多纳米材料,包括脂质体 [3]、聚合物 [4]、纳米粒子 [5]、树枝状聚合物 [6]、胶束 [7] 和氧化石墨烯 [8, 9],已被开发用于输送各种药物。在这些纳米材料中,氧化石墨烯(GO)是一种从氧化石墨化学剥离的新型碳纳米材料,具有丰富的官能团、大比表面积、高载药量和优异的分散性等物理和化学性质。在水中的能力 [10,11,12]。此外,大多数体外实验结果表明,低浓度的 GO 可作为细胞生长的底物并激活免疫细胞。因此,GO 已广泛应用于疾病诊断 [13]、癌细胞成像和追踪 [14]、癌症光热治疗 [15]、组织工程 [16]、靶向药物递送 [17],尤其是作为一种抗肿瘤药物载体[18, 19]。然而,一些研究小组报告说,高浓度的 GO 在临床前和临床研究中具有明显的细胞毒性作用。 GO 在体内产生毒性作用的机制是通过氧化应激和细胞内活性氧的过量产生,诱导细胞凋亡并引起严重的炎症、肺水肿和肉芽肿形成 [20]。因此,解决GO毒性问题至关重要。
据报道,共价或非共价键的功能化可以减少 GO 与细胞之间的强疏水相互作用。几项研究证明了这一点,这些研究表明 GO 功能化提高了其生物相容性并几乎消除了其体内和体外毒性。 Yang 等人。首次使用放射性标记方法研究了共价结合 PEG-GO 在小鼠体内的长期生物分布,结果表明 PEG-GO 可以逐渐从小鼠体内排泄,可能在尿液和粪便中 [21]。张等人。将 DEX 功能化的 GO 与 GO 进行比较,发现 GO-DEX 可以显着降低细胞毒性,并且在一周内从小鼠中大部分清除 [22]。此外,GO 与普朗尼克 F127 的非共价结合导致生理条件下的良性溶解度和稳定性,以及低毒性 [23]。尽管已经使用了几种聚合物或分子来对 GO 进行功能化,但在该领域已经取得了显着的成果。然而,仍然需要努力开发简单的方法来构建良好的生物相容性GO基药物载体。
牛磺酸(Tau)是一种半必需氨基酸,具有良好的稳定性和水溶性。 Tau可以预防心脑血管疾病,维持视觉功能,保护细胞,调节免疫力。大量研究表明,Tau 通过上调或下调在各种癌症(包括肺癌、胃癌、结直肠癌和乳腺癌)中发挥重要作用的表达因子而具有抗肿瘤特性 [24]。因此,Tau 功能化的 GO 作为抗肿瘤药物的载体可能发挥优越的作用。在本文中,我们首次使用共价 Tau 功能化的 GO 作为纳米载体,并在体外评估了其细胞毒性。此外,5-氟尿嘧啶(5-FU)被用作抗癌药物,非共价负载在 Tau-GO 表面以构建药物递送系统。 5-FU-Tau-GO 不仅可以减少对正常组织的副作用,还可以提高药物的生物利用度。因此,Tau-GO被成功开发为一种新型的基于GO的纳米材料,在未来可能具有重要的生物医学应用。
实验与方法
材料
石墨粉、磷酸盐缓冲液(PBS)、二甲基亚砜(DMSO)购自天津莱博化工有限公司;碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、盐酸(HCl)和双氧水(H2O2 30%)购自山东豫旺实业有限公司;牛磺酸(Tau)、5-氟尿嘧啶(5-FU)、人肝癌细胞(HepG2)、青霉素-链霉素溶液、胎牛血清(FBS)购自大连美伦生物科技有限公司;硫酸(H2SO4 98%)和高锰酸钾(KMnO4)购自南京化学试剂有限公司;硝酸钠(NaNO3)和十二烷基硫酸钠(SDS-Na)购自上海金金乐实业有限公司; MTT 购自 Sigma-Aldrich, Inc; DMEM 购自 HyClone, Inc;大鼠购自本溪长盛实验动物中心。其他试剂均为分析纯,市售可得。
GO 综合
GO 是根据改进的 Hummer 方法由石墨粉制备的。首先,将三颈烧瓶置于带温度计的冰浴中,沿烧瓶壁加入 168 mL 98% 硫酸,待温度达到 5°C 时加入 5 g 石墨和 4 g 硝酸钠。然后,分批缓慢加入22.5g高锰酸钾1小时,温度保持在5℃以下。之后,将三颈烧瓶转移到油浴中,所得混合物在35°C反应30分钟,然后升温至65°C并搅拌反应30分钟。在此步骤之后,将温度升至 85°C,并将混合物进一步反应 1 小时以获得紫褐色糊状物。将该混合物在室温下静置1周,转移到装有700mL热水的烧杯中,滴加30%过氧化氢直至变成黄褐色。将混合物以 10,000 rpm 离心,用热水洗涤,并重复此过程数次,直到上清液的 pH 值为 7.0。最后将产物在真空冷冻干燥机中干燥,得到纳米GO。
Tau-GO 合成
准确称量的 50 毫克 GO 溶解在 50 毫升蒸馏水中,然后加入 150 毫克 EDC 和 100 毫克 NHS,通过在冰水浴中超声 20 分钟来激活 GO。接下来,将 10 mL Tau 水溶液(0.1 g/mL)缓慢(逐滴)加入制备的 GO 水溶液中,并用 HCl 将 pH 值调至 6-7,并在室温下避光连续搅拌 24 h。通过以 5000 rpm 离心 10 分钟收集产物并用蒸馏水洗涤 3 次。冷冻干燥后收集Tau-GO。
5-FU 加载
将一定量的 20 毫升 Tau-GO 溶液超声处理 2 小时。准确称量的5-FU溶解在适量的蒸馏水中,在室温搅拌下缓慢滴加到制备的Tau-GO溶液中,然后在30°C避光超声1.5小时。将产物在 4°C 下以 5000 rpm 离心 10 分钟。下层沉淀物用 20 mL 蒸馏水洗涤并离心(4°C 下 5000 rpm 10 分钟),该过程重复 3 次。下层冻干,取上清液置于烧杯中,称取体积,5-FU浓度用1200高效液相色谱仪(美国安捷伦)测定。检测条件如下:色谱柱:C18(4.6 × 250 nm,5 μm);柱温:25°C;流动相:0.1% KH2PO4 溶液,pH 5.5;流速:1.0 mL/min;进样量:20μL;和测量波长:265 nm。包封率(EE)和载药率(LE)由下式求得:
$$\begin{aligned} {\text{EE}}\left( \% \right) &=\frac{{M_{1} - C_{1} \times L_{1} }}{{M_{1 } }} \times 100\% \\ {\text{LE}}\left( \% \right) &=\frac{{M_{1} - C_{1} \times L_{1} }}{{ 20C_{0} + M_{1} - C_{1} \times L_{1} }} \times 100\% \\ \end{aligned}$$5-FU总剂量记为M1,游离5-FU浓度和体积记为C1和L1,载体浓度记为C0。
特征化
为了表征制备的纳米复合材料,从 4000 到 400 cm -1 扫描傅里叶变换红外 (FT-IR) 光谱 在 IRAffinity-1 光谱仪(日本岛津)上确认相互作用。 UV-vis 吸收光谱记录在 UV-3600 扫描分光光度计(日本岛津)上。将样品溶解在蒸馏水中,并在 Nano-ZS 90 Nano 仪器(英国马尔文)上获得粒度、zeta 电位和 PDI 值。使用 JEM-2100 透射电子显微镜 (TEM) (JEOL, Japan) 分析样品的形态。热重分析 (TGA) 使用热重分析仪 (NETZSCH, Germany) 在氮气氛下以 10°C/min 的加热速率从 0 到 800°C 进行。样品的 XRD 测量是通过 X 射线衍射仪(Bruker,德国)用铜 CuKα 辐射(λ =1.5406 Å) 以 2θ 角的广角。 XPS 测量是使用 Omicron ESCA 探针和单色 Al Karadiation (Thermo, America) 进行的。
体外药物释放
体外药物释放分别在 pH 1.2(模拟胃环境)、pH 6.5(模拟肝癌细胞环境)和 pH 7.4(模拟生理环境)、37°C(模拟体温)下进行。简而言之,将 15 mg 5-FU-Tau-GO 放入透析膜中,浸入 50 mL 含有 0.1% SDS-Na、pH 为 1.2、6.5 和 7.4 的缓冲溶液中。将所有样品置于速度为 100 rpm 且温度为 37°C 的连续振荡水浴中。在预定时间点(0 分钟、5 分钟、10 分钟、20 分钟、30 分钟、1 小时、1.5 小时、2 小时、2.5 小时、3 小时、4 小时、8 小时、12 小时、24 小时、48 小时和72 h),取 1 mL 每个样品并替换为 1 mL 含有 0.1% SDS-Na 的新鲜缓冲溶液,以保持相同体积的释放介质。离心释放出的培养基,1200 HPLC分析。
体外细胞毒性研究
MTT 分析
MTT 测定用于评估 5-FU、Tau-GO 和 5-FU-Tau-GO 的细胞毒性。简而言之,将人肝癌 HepG2 细胞在补充有 10% FBS 和 1% 抗生素(青霉素-链霉素溶液)的 DEME 培养基中在 37°C 下在 5% CO2 的湿润气氛中培养。将细胞以5 × 10 3 的密度接种于96孔板中 每孔含有 100 μL DEME 培养基的细胞,并辅以 FBS 和抗生素。将板放入含有 5% CO2 的 37°C 加湿室中 24 小时。之后,移除生长培养基并重新填充含有不同浓度(5、10、20、40、60、80 和 100 μg/ml)的 5-FU、Tau-GO、5-FU-的 100 μL 新鲜培养基。分别为 Tau-GO。孵育 24 小时后,将细胞用 20 μL MTT 溶液处理并进一步孵育 4 小时。接下来,吸出培养基,并将甲臜晶体溶解在 150 μL DMSO 中。最后,将孔板在恒温振荡器中在 37°C 下振荡 15 分钟。使用酶标仪在 570 nm 处测量每个样品的光密度 (OD)。实验一式三份完成。细胞抑制率按以下公式计算:
$${\text{Cell}}\;{\text{inhibition}}\;{\text{rate}} =\frac{{{\text{OD}}_{{{\text{control}}} } - {\text{OD}}_{{{\text{treatment}}}} }}{{{\text{OD}}_{{{\text{control}}}} }} \times 100\ %$$其中ODcontrol为未经处理的对照细胞获得的吸光度,OD处理过的为处理过的细胞获得的吸光度。
AO/EB 染色分析
AO/EB双染色用于评价5-FU、Tau-GO、5-FU-Tau-GO处理后细胞的形态变化。简而言之,将处于对数生长期的 HepG2 细胞以每孔 10,000 个细胞的密度接种在 6 孔板中,并在 37°C 和 5% CO2 气氛下的培养箱中培养。 24 小时后,用固定浓度的 5-FU、Tau-GO 或 5-FU-Tau-GO 处理细胞,并进一步孵育 24 小时。除去每孔中的培养基,用PBS洗涤细胞两次。接下来,将补充有 40 μL 荧光染料(1 mg/mL AO 和 1 mg/mL EB 以 1:1 的比例混合)的 1 mL PBS 添加到每个孔中,并在无光下孵育 10 分钟。在荧光显微镜下观察染色的细胞并随机拍摄图像。
药代动力学研究
所有动物实验均按照动物保护和伦理委员会制定的政策和原则进行。 24只雄性SD大鼠,体重230-270g,禁食12h,给药前随机分为4组。 A、B组静脉注射5-FU和5-FU-Tau-GO溶液,C、D组分别口服5-FU和5-FU-Tau-GO溶液。所有组均接受 20 毫克/公斤的剂量。给药后,在给定时间点(15 分钟、1 小时、2 小时、4 小时、6 小时、8 小时、12 小时、16 小时、24 小时和 48 小时)将血样(约 0.5 mL)收集到抗凝管中。 H)。通过以 7500 rpm 和 4°C 离心 10 分钟来分离血浆样品。然后,将 200 μL 血浆和 50 μL (NH4)2SO4 混合在管中(10 μL 40 μg/mL 5-BrU 内标溶液,在 40 °C 水浴中用氮气吹干,涡旋 5 分钟并离心以 10800 rpm 离心 3 分钟。接下来,向管中加入 900 μL 乙酸乙酯/异丙醇溶液(85:15,v/v),涡旋 3 分钟,然后以 10800 rpm 离心 15 分钟。取出上清液并干燥加氮气,加入100 μL流动相,涡旋1 min,最后用1200 HPLC测定上清液。
分子动力学模拟
分子动力学模拟主要用于分析药物与载体的相互作用力和药物的扩散行为。 5-FU的化学结构使用chem office 2014的Chemdraw构建,Tau-GO和GO的结构使用Materials Studio分子模拟软件(7.0版,Accelrys Inc.)在Polymer and Molecule Builders模块中进行。 , 美国)。所有构建的化合物在 COMPASS II 力场下进行几何优化,选择能量最低的构象作为稳定构象。对每个系统进行 10 ps 的 NVT 平衡。模拟以 100 ps MD 进行,以在 298 K 和 101.325 kPa 下获得平衡结构,步长为 1 fs。最后得到各体系的均方位移(MSD)和内聚能密度(CED),扩散系数(D)由下式给出:
$$D =\frac{1}{2d}\mathop {\lim }\limits_{\tau \to \infty } \frac{{\text{d}}}{{{\text{d}}\tau }}\left[ {\left. {r\overrightarrow {\left( t \right)} - r\overrightarrow {\left( 0 \right)} } \right]} \right.^{2}$$其中 d 是系统的维度,\(r\overrightarrow {\left( t \right)}\) 和\(r\overrightarrow {\left( 0 \right)}\) 是时间t 和 0 分别为 \(\left[ {\left. {r\overrightarrow {\left( t \right)} - r\overrightarrow {\left( 0 \right)} } \right]} \right.^{ 2}\) 代表 MSD。
结果与讨论
特征化
Tau-GO 偶联物由 GO 和 Tau 的酰胺键制成。 FT-IR 光谱验证了纳米复合材料的成功合成(图 1)。 GO 上氧官能团的存在通过-OH (~ 3405 cm -1 ), C=O (1723 cm −1 ), C=C (1628 cm −1 ) 和 C–OH (1391 cm −1 )。这些结果证明 GO 制备成功(图 1a)[25]。除了一些 GO 特征峰外,1638 cm −1 处的新峰 和 3427 cm −1 对应于酰胺基团,1164 cm -1 和 1085 cm −1 对应于-SO。 Tau-GO 光谱清楚地表明 Tau 已在 GO 表面功能化(图 1b)。在图 2b 中,–SO3 在 1164 cm -1 处的特征峰 被氢键作用淹没,在 FT-IR 光谱中不可见。因此,5-FU成功加载到Tau-GO上。
<图片>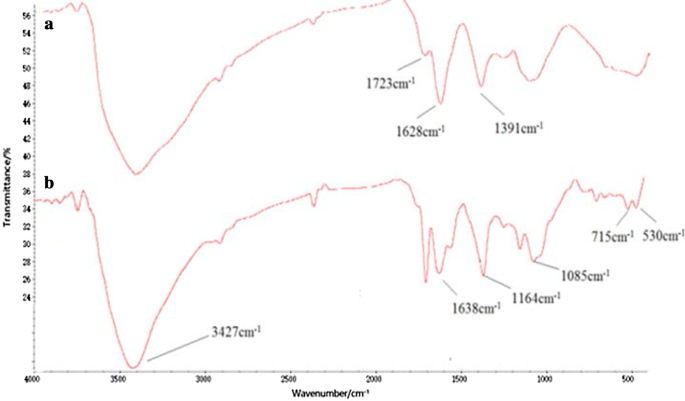
GO (a ) 和 Tau-GO (b )
<图片>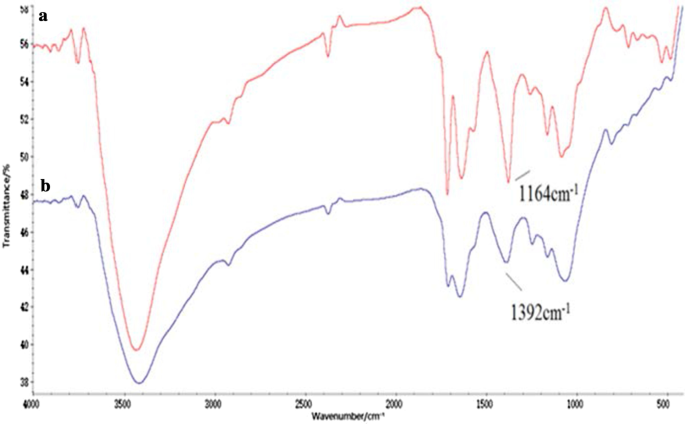
Tau-GO (a ) 和 5-FU-Tau-GO (b )
GO UV-Vis 吸收光谱如图 3 所示。234 nm 处的明显吸收峰归因于石墨烯 C=C 键的 π-π* 跃迁。此外,300 nm 肩峰归因于羧基或羰基上的氧化石墨烯 C=O 键的 n-π* 跃迁。两个特征吸收峰证明GO制备成功。
<图片>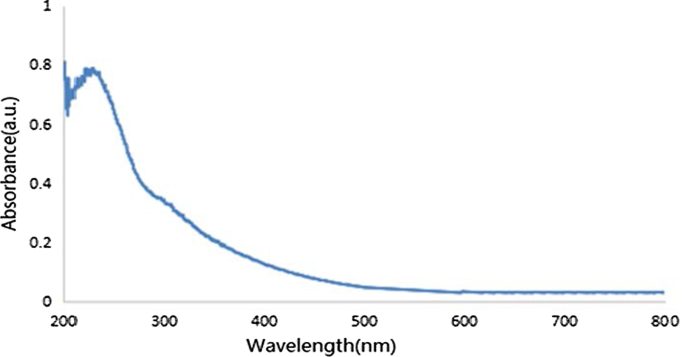
GO的紫外光谱
GO、Tau-GO 和 5-FU-Tau-GO 的大小如图 4 所示。GO、Tau-GO 和 5-FU-Tau-GO 的 zeta 电位如图 5 所示。 GO 片约 221 nm,PDI 值约 0.188,表明制备的 GO 分布均匀,稳定性好。 zeta 电位约为 − 33.3 mV,表明负电荷主要是由于表面存在许多含氧基团。当通过酰胺键用 Tau 修饰 GO 时,氨基取代了一些羧基,-SO3 在溶液中具有更强的电离能力,zeta 电位降低并变为 - 38.8 mV。 Tau-GO 的尺寸和 PDI 值约为 242 nm 和 0.190。接下来,通过非共价键将 5-FU 加载到 Tau-GO。 zeta 电位约为 - 26.7 mV,绝对值大于 20 mV。此外,5-FU-Tau-GO的粒径和PDI值约为264 nm和0.182,说明颗粒间静电斥力大,不易引起聚集或沉淀,Tau具有良好的水溶性, GO 还具有良好的水溶性,因为其表面被含氧官能团改性。使用Tau-GO载体负载5-FU显着提高了5-FU的水溶性,使5-FU-Tau-GO在水溶液中稳定分散。
<图片>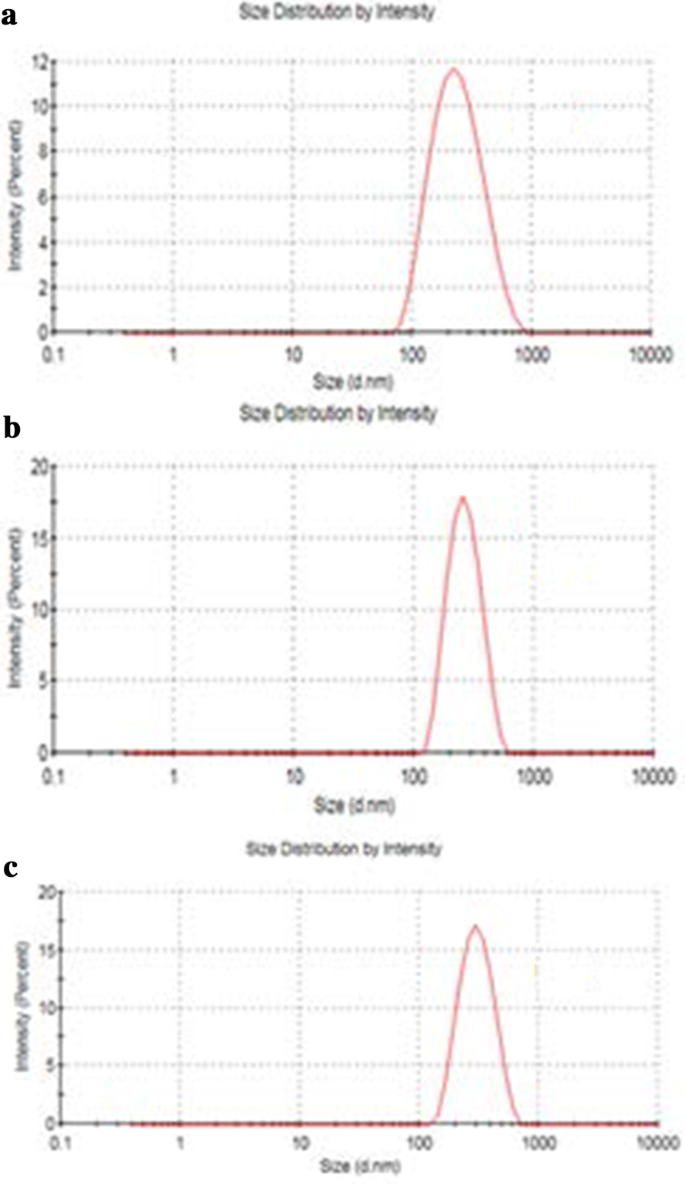
GO 的粒径 (a ), Tau-GO (b ) 和 5-FU-Tau-GO (c )
<图片>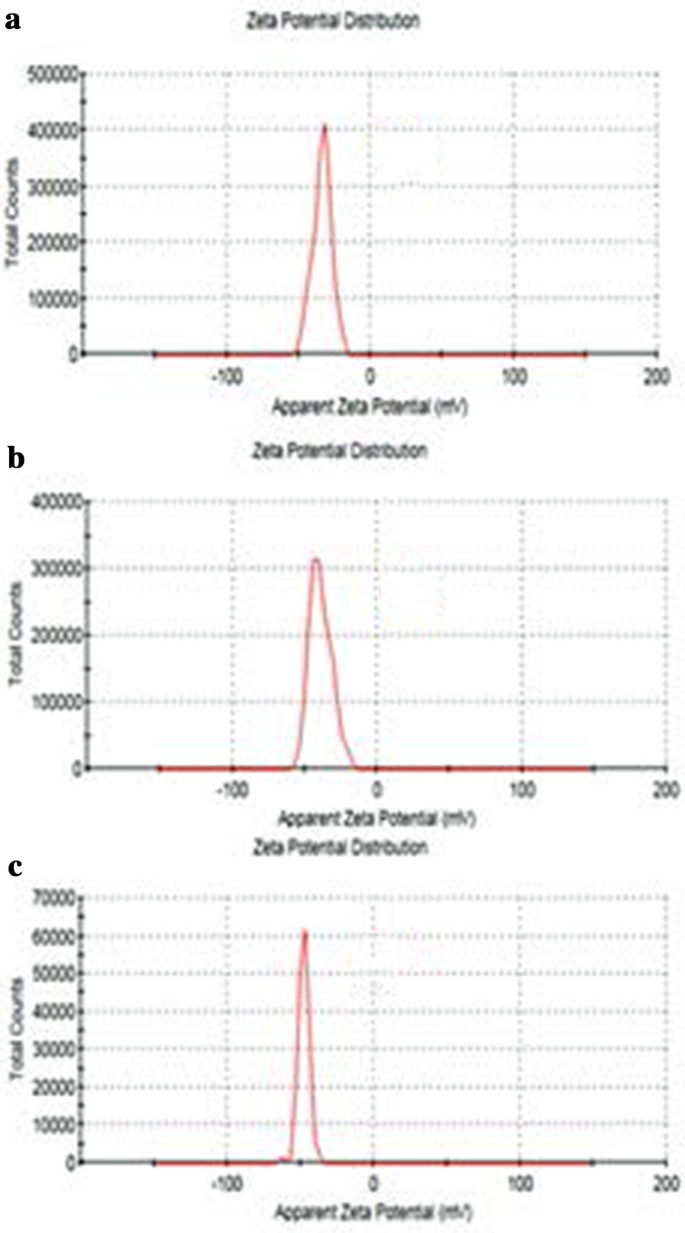
GO 的 Zeta 电位 (a ), Tau-GO (b ) 和 5-FU-Tau-GO (c )
GO、Tau-GO 和 5-FU-Tau-GO 的形态通过 TEM 表征(图 6)。 GO是表面有皱纹的平面结构,说明它是平面二维结构(图6a)。与 GO 相比,Tau-GO 的尺寸略有增加,但仍呈现层状结构(图 6b)。 5-FU-Tau-GO 图像显示材料没有聚集或改变,GO 的初始层状结构保持完整(图 6c)。因此,Tau-GO和5-FU-Tau-GO具有良好的稳定性。
<图片>
GO 的 TEM (a ), Tau-GO (b ) 和 5-FU-Tau-GO (c )
热重分析用于量化复合材料的组成。 GO 和 Tau-GO 的 TGA 曲线如图 7 所示。在 800°C 的氮气氛中,GO 和 Tau-GO 的残余质量分别为 39.73% 和 34.22%。因此,当比较重量变化值时,确定Tau-GO中Tau的含量约为13%。
<图片>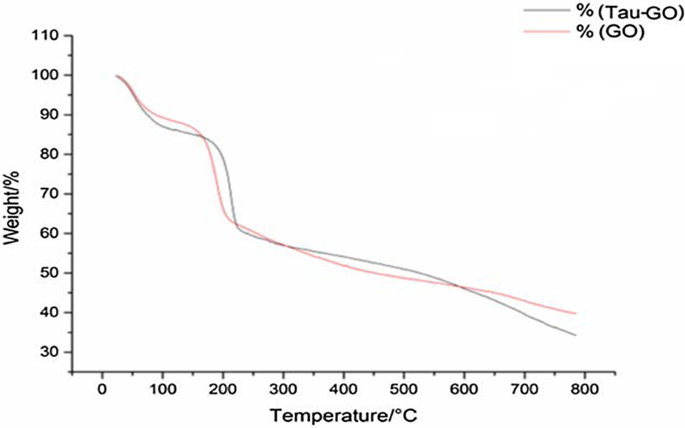
GO和Tau-GO的TAG
Tau、GO 和 Tau-GO 的 XRD 谱如图 8 所示。在 2θ 值的 10.7°处可以观察到 GO 的特征峰,这证实了 GO 形成完全氧化的强化学氧化和剥离过程.在 GO 表面用 Tau 功能化后,峰的衍射图案在 2θ 值 8.2 处略有下降。这意味着 Tau 已经成功地对 GO 进行了功能化。
<图片>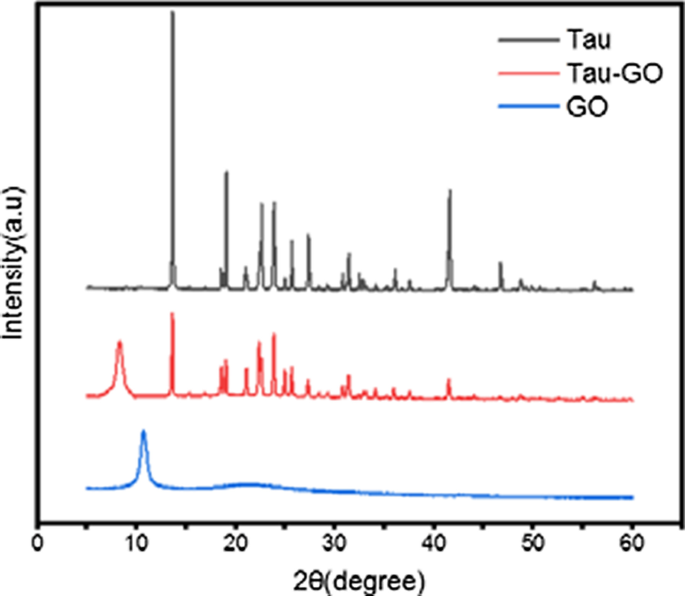
Tau、Tau-GO和GO的XRD图
GO 和 Tau-GO 的 C1s XPS 光谱如图 9 所示。GO 的 C1s XPS 光谱表明存在相当程度的氧化,存在对应于不同官能团的四个碳原子。 Tau-GO 的 C1s XPS 光谱也显示出这些相同的碳原子。此外,C-N 键相关组分峰的出现归因于氨基、酰胺基团。这些结果也表明 Tau 成功地对 GO 进行了功能化。
<图片>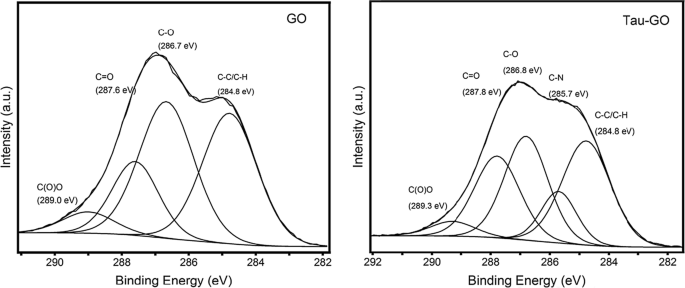
GO和Tau-GO的C1s XPS模式
药物加载和释放行为
5-FU 通过非共价相互作用吸附到 Tau-GO 纳米载体上。 5-FU 校准曲线为 y =62.135x + 21.873 (r =0.9999),范围为 6.5 ~ 250 µg/mL。通过未结合的药物浓度确定包封率(EE)和载药效率(LE),以评估载药性能。结果表明,EE随着药物浓度的增加而增加,EE的最高值为83.2%。根据公式,LE 为 33.7%,即 508.52 μg 5-FU 可吸附在 1 mg Tau-GO 上。因此,Tau-GO 是一种很有前途的药物载体,可以实现大载药量。 5-FU 在 Tau-GO 上高负载能力的可能机制可以概括为以下解释:首先,Tau 用于功能化 GO 并引入活性官能团(-SO3)。 –SO3 在溶液中具有很强的电离能力,减少了 GO 之间的团聚,有利于 5-FU 加载到 Tau-GO 中。其次,5-FU-Tau-GO 的 Zeta 电位与 Tau-GO 的 Zeta 电位相差 12.1 mV,表明 5-FU 负载在 Tau-GO 表面,静电相互作用在加载 5-FU。最后,5-FU和Tau-GO载体之间存在多种形式的氢键,包括Tau-GO中的-COOH和5-FU中的-NH-,Tau-GO中的-COOH和5-FU中的C=O , Tau-GO 中的 –OH 和 5-FU 中的 –NH–,Tau-GO 中的 –OH 和 5-FU 中的 –C=O,Tau-GO 中的 –COOH 和 5-FU –Tau-GO 中的 – Tau-GO中的COOH和5-FU中的-F,这些氢键使5-FU-Tau-GO在溶液中稳定。
在 pH 1.2、6.5 和 7.4 PBS 溶液(分别模拟胃环境、肝癌细胞环境和生理环境)中,在 37°C 温度下,5-FU-Tau-GO 中 5-FU 的体外累积释放如图 10 所示。发现 5-FU 的释放行为受环境 pH 值的影响。在 pH 7.4 的缓冲液中,药物释放缓慢且持续,72 小时后药物的总释放量约为 70.84%。相比之下,在同一时间点,pH 7.4 的药物释放量显着低于 pH 1.2 和 pH 6.5。从 5-FU-Tau-GO 释放的总载药量可分别达到约 90.29% 和 85.75% 以及 pH 1.2 和 pH 6.5。这可以归因于 5-FU 和 Tau-GO 之间的 π-π 相互作用和氢键。 pH值越低,氢键的质子化程度越高。因此,氢键强度受pH值控制,导致5-FU的释放。这种pH敏感的给药系统在抗肿瘤药物中发挥着重要作用,可以实现药物释放到肿瘤细胞中。
<图片>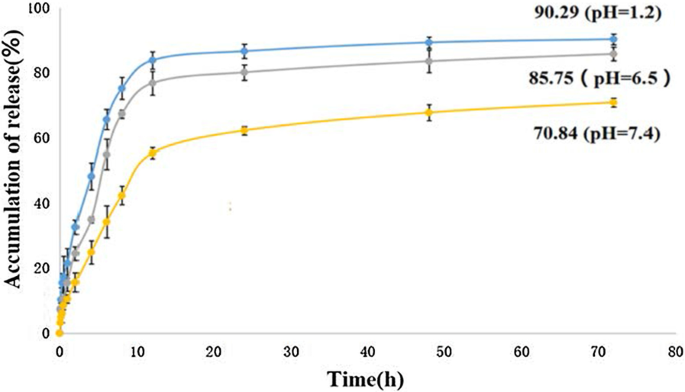
5-FU-Tau-GO 在 37 °C 磷酸盐盐水中的体外释放曲线
体外细胞毒性研究
为了评估纳米载体的潜在毒性和肿瘤治疗功效,使用 MTT 测定在 HepG2 细胞中进行体外细胞活力(图 11)。 Tau-GO 在不同浓度下没有表现出显着的细胞毒性。 5-FU负载后,5-FU-Tau-GO表现出明显的抑制作用,并且呈剂量依赖性,因此,纳米载体具有递送抗肿瘤药物的能力。 5-FU-Tau-GO 的 IC50 值为 65.2 ± 0.7 μg/mL,比游离 5-FU (196 ± 8.73 μg/mL) 毒性更大。这可能是由于牛磺酸具有诱导肿瘤细胞凋亡的能力,从而间接增强了5-FU对细胞的抑制作用。此外,从体外释放实验可以看出,负载在Tau-GO上的5-FU可以在细胞内逐渐释放。因此,5-FU-Tau-GO对细胞的作用时间比游离5-FU长,从而产生更好的抑制作用。
<图片>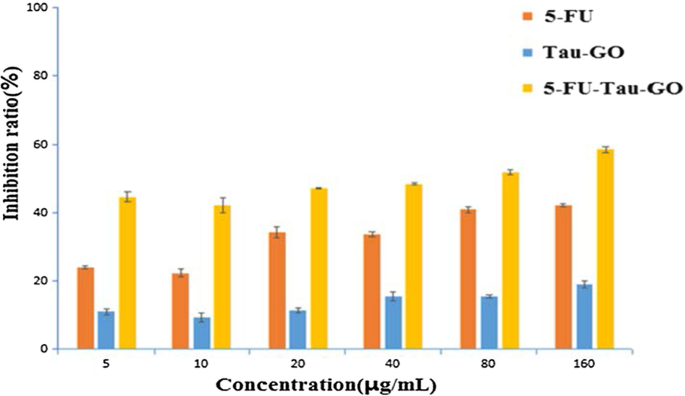
The viability of different concentrations of 5-FU, Tau-GO, and 5-FU-Tau-GO
AO fluorescent agent could emit green fluorescence when it passed through intact cell membranes and stained nuclei, while EB only marked the nucleus of damaged cells that emitted a red/orange fluorescence. The cells with early and late apoptosis presented greenish yellow or orange nuclei with the AO/EB stain, respectively. Therefore, AO/EB staining was performed to investigate whether the cells death was associated with apoptosis using characteristics of cell morphological changes. The results obtained from the AO/EB staining are presented in Fig. 12. Control cells were in spindle shape and with green nuclei. In the cell group that was cultured with Tau-GO alone, small parts of the nuclei were invaginated and with dark green or orange-red staining. Significant orange or red apoptotic cells with chromatin fragments and apoptotic bodies were observed in the 5-FU alone group. Compared with 5-FU, 5-FU-Tau-GO caused more damage to HepG2 cell morphology, which not only broke the cells, but also caused a large amount of apoptosis in cancer cells. As can be seen from the pictures, almost all the cells that were treated with 5-FU-Tau-GO, had morphological changes, a large number of cell debris and apoptotic bodies, indicating that the 5-FU-Tau-GO nano drug delivery system had a good killing effect on HepG2 cells.
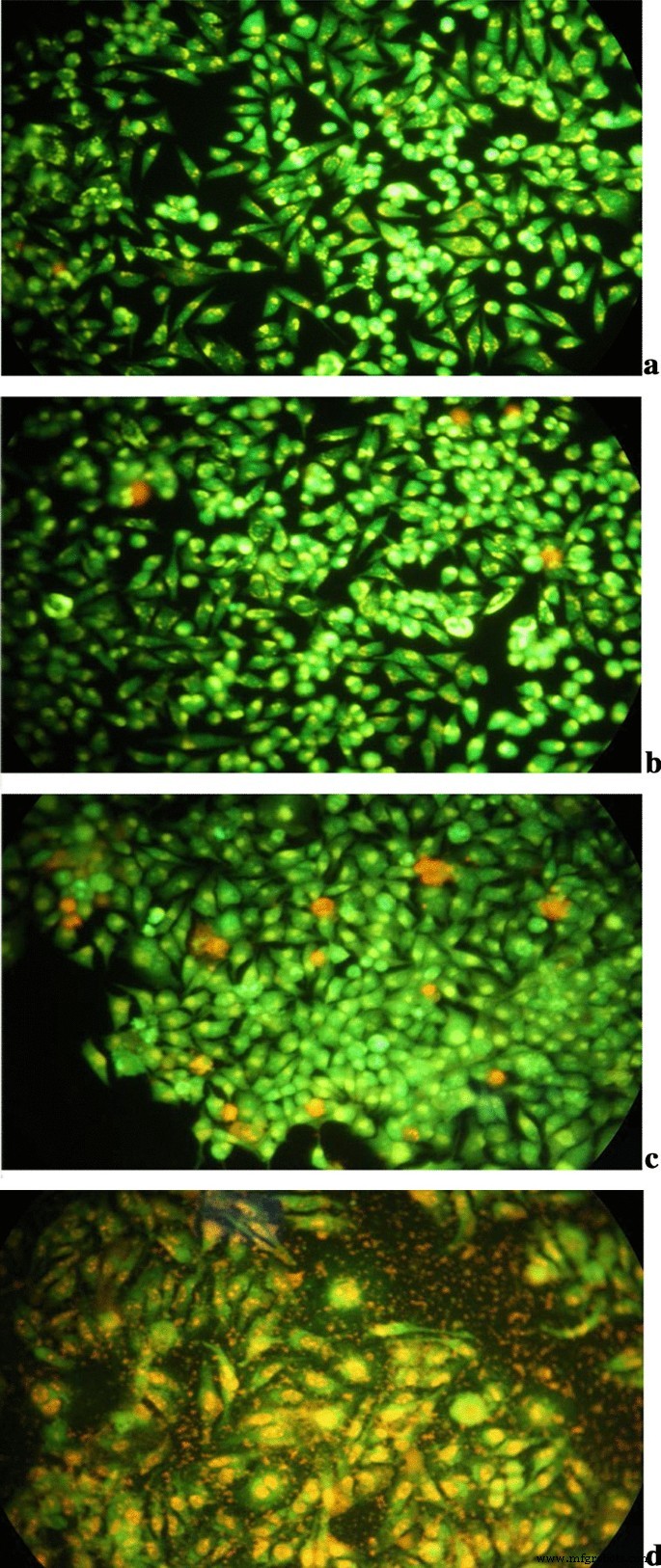
The AO/EB of control (a ), Tau-GO (b ), 5-FU (c ), and 5-FU-Tau-GO (d )
Pharmacokinetic Studies
The pharmacokinetic studies of 5-FU and 5-FU-Tau-GO were performed in SD rats. The profiles of 5-FU concentration in plasma vs. time, following oral administration, are presented in Fig. 13a. We found that the tendency of the two curves was similar, but the 5-FU plasma concentration from the 5-FU-Tau-GO nanocarrier was higher than that from the 5-FU alone and this was observed at each measured time point. Figure 13b shows the 5-FU in vivo release profiles via tail vein. The 5-FU-Tau-GO could achieve sustained drug release over 24 h, and the drug concentration gradually decreased in the first few hours, indicating that 5-FU was slowly released.
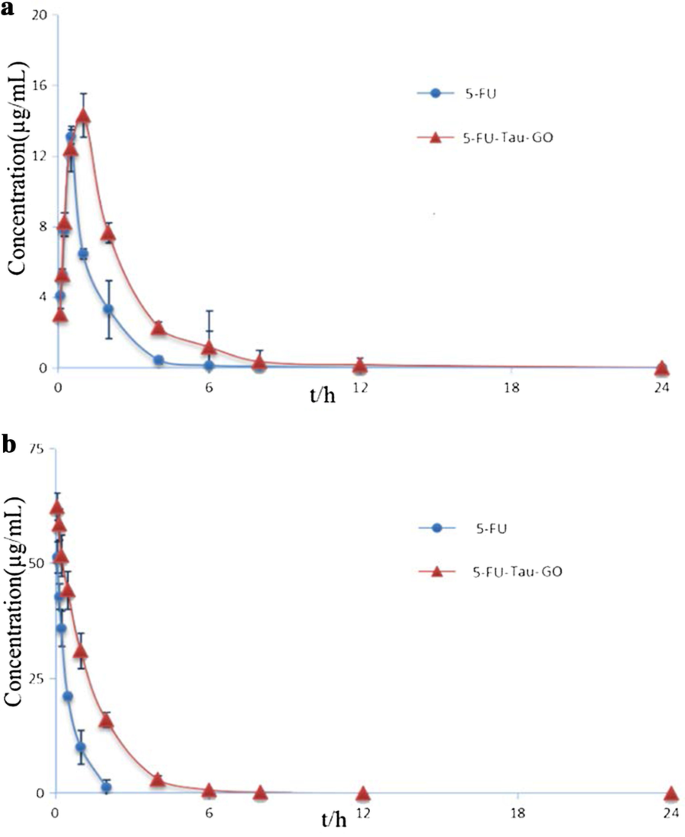
In vivo pharmacokinetic standard curves of 5-FU and 5-FU-Tau-GO through oral administration (a )。 In vivo pharmacokinetic standard curve of 5-FU and 5-FU-Tau-GO through intravenous injection (b )
The two-compartment model was used to analyze the pharmacokinetic parameters of oral or intravenous administration in rats. The pharmacokinetic parameters are presented in Table 1. Compared with the 5-FU, the 5-FU-Tau-GO showed higher T1/2β that were 2.3 times by oral administration, and 3.0 times by intravenous injection, respectively. Moreover, the area under the concentration time curve (AUC0−t) of 5-FU-Tau-GO nanocomplexes was roughy 2.1-fold higher through the oral administration, and 2.8-fold higher through intravenous injection when compared to that of the 5-FU solution, respectively. Therefore, we concluded that 5-FU-Tau-GO could significantly extend 5-FU retention time in vivo and improve bioavailability. In addition, the T1/2β of the 5-FU-Tau-GO nanocomplexes that were orally administered (1.67 ± 1.15 h), was longer than that of the intravenous injection (1.33 ± 0.64 h); however, the AUC0−t of oral administration (36.02 ± 1.83 mg/L*h) was lower than that of intravenous injection (96.50 ± 8.70 mg/L*h). These results might be due to two aspects:on the one hand, when administered by intravenous injection, the drug directly enters the blood system for circulation and without passing through the gastrointestinal barrier for redistribution; on the other hand, because 5-FU easily causes a certain damage to the gastrointestinal system, it may also affect the effective use of drugs in the body.
MD Simulations
The docking and molecular dynamics of unmodified GO, Tau-GO and 5-FU were simulated by molecular docking and molecular dynamics simulation. The molecular docking results of GO, Tau-GO and 5-FU are shown in Fig. 14, where it can be seen that the bond lengths of 5-FU and GO and Tau-GO are 3.66 Å and 2. 602 Å, respectively. Moreover, from the calculation results, the binding energies of 5-FU to GO and Tau-GO were 47.69 kcal/mol and 25.04 kcal/mol, respectively. These indicated that the binding force of Tau-GO and 5-FU was stronger than that of GO and 5-FU. This is due to Tau polar atoms, such as S and N, forming a stronger non-covalent bond with 5-FU, that makes the force between Tau-GO and 5-FU stronger.
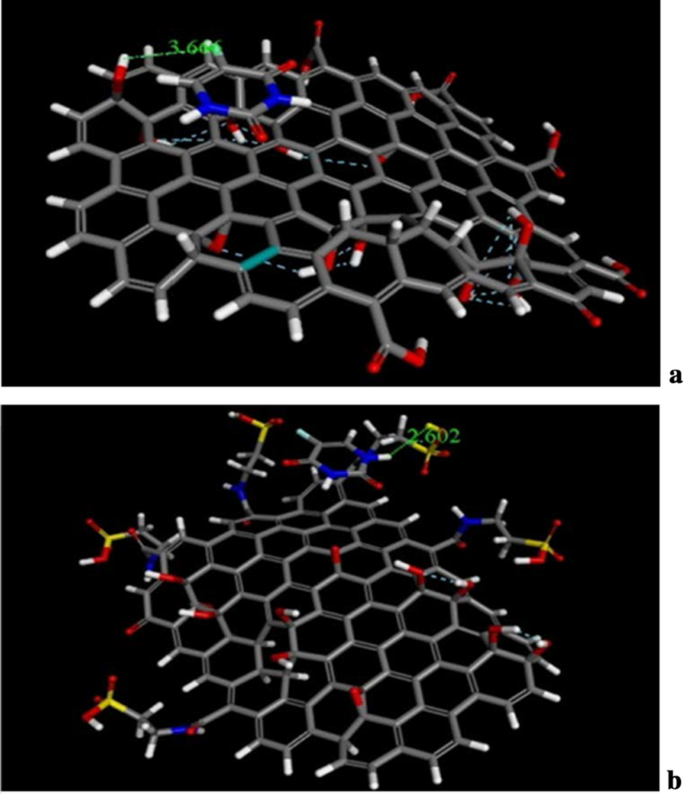
The Molecular docking of GO sheets with 5-FU (a )。 The molecular docking of Tau-GO with 5-FU (b )
The diagrams of the molecular dynamics simulation of GO, Tau-GO and 5-FU were shown in Fig. 15. According to the calculation results, the CED of 5-FU-GO and 5-FU-Tau-GO were 2.67*10 8 and 2.83*10 8 , 分别。 These results showed a stronger interaction between the drug and the Tau-GO. The graphs between MSD and time were plotted (Fig. 16) to obtain the diffusion coefficient via MSD. The drug diffusion coefficients were obtained by the slope divided by 6 as follows:0.094m 2 /s and 0.058 m 2 /秒。 These show that the force between Tau-GO and 5-FU is stronger, which is consistent with the results of the molecular docking. Therefore, the functionalized GO makes the entire carrier more abundant in atoms and groups; Therefore, making the non-covalent bond with 5-FU stronger, and the entire system more stable.
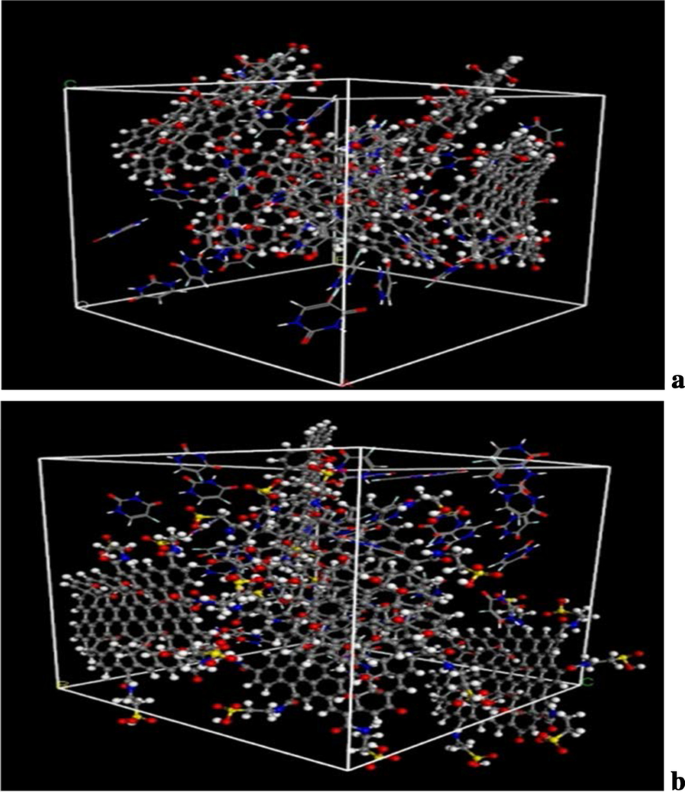
Snapshots of the GO and 5-FU at the end of the MD (a )。 Snapshots of the Tau-GO and 5-FU at the end of the MD (b )
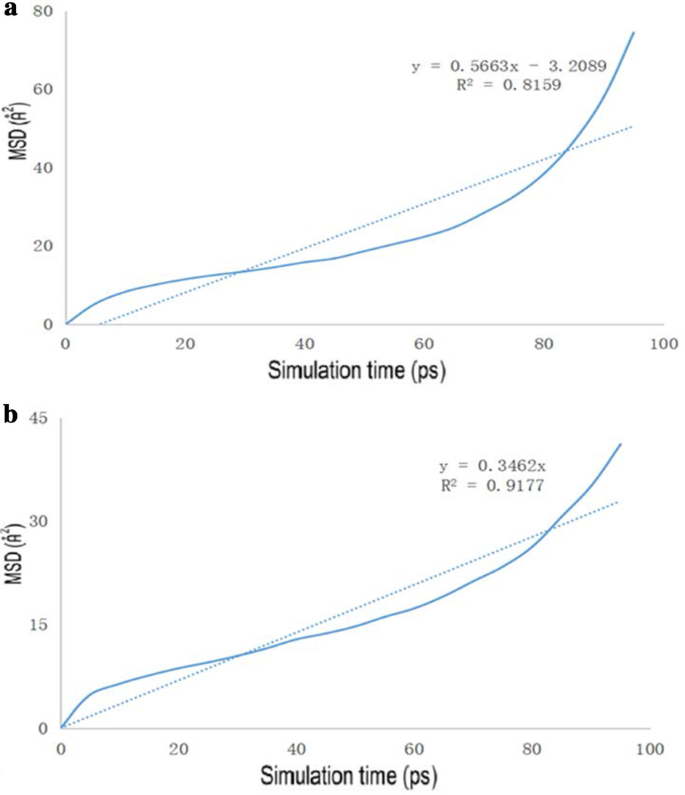
The drug MSD profiles of the GO and 5-FU (a ), Tau-GO and 5-FU (b )
Conclusions
In summary, we successfully prepared a Tau-GO nanocomposite through a simple chemical method. GO functionalization with Tau has a good stability and improves its biocompatibility. The unique structure and brilliant properties of Tau-GO nanocarriers offer great opportunities for the loading and delivery of 5-FU. The 5-FU-Tau-GO has a potential anti-tumor ability and an excellent circulation time of drugs. Therefore, we believe that the modification of GO by the carrier Tau for 5-FU loading, is an effective and applicable tool for constructing a 5-FU-Tau-GO nano drug delivery system for the delivery of anticancer drugs and anti-tumor therapy.
数据和材料的可用性
当前研究中使用和/或分析的数据集可根据合理要求向相应作者索取。
缩写
- 开始:
-
氧化石墨烯
- Tau:
-
Taurine
- 5-FU:
-
5-Fluorouracil
- 5-FU-Tau-GO:
-
Taurine functionalized graphene oxide loading 5-fluorouracil
- EE:
-
Encapsulation ratio
- LE:
-
Drug-loading efficiency
- FT-IR:
-
傅里叶变换红外
- TEM:
-
透射电子显微镜
- TGA:
-
热重分析
- MSD:
-
Mean square displacement
- CED:
-
Cohesive energy density
纳米材料
- 用于增强药物递送的纳米纤维和细丝
- 生物相容性 FePO4 纳米颗粒:药物递送、RNA 稳定和功能活性
- 钛酸盐纳米管装饰氧化石墨烯纳米复合材料:制备、阻燃和光降解
- 石墨烯和氧化石墨烯的体外和体内生物安全和抗菌能力
- RGO 和三维石墨烯网络共同修饰的高性能 TIM
- 氮化处理的基于 HfO2 的 RRAM 中的传导机制和改进的耐久性
- 不同粒径阿维菌素纳米递送系统的制造、表征和生物活性
- 石墨烯/WO3 和石墨烯/CeO x 结构作为超级电容器应用电极的评估
- 具有超弹性和高电容的石墨烯/聚苯胺气凝胶作为高抗压超级电容器电极
- 通过多元醇介导工艺制备和表征 ZnO 纳米夹
- 氧化石墨烯的低温还原:电导率和扫描开尔文探针力显微镜
- 磨石剥落:大尺寸少层氧化石墨烯的真正剪切剥落


