辣根过氧化物酶封装的空心二氧化硅纳米球用于细胞内活性氧种类的传感
摘要
活性氧 (ROS) 在细胞信号传导和体内平衡中起着至关重要的作用。 ROS 的过量产生可诱导对各种生物分子和细胞结构的氧化损伤。因此,开发一种能够监测和量化活细胞中 ROS 的方法对于生理学和临床诊断具有重要意义。开发的一些细胞渗透性荧光探针可用于检测 ROS,同时与辣根过氧化物酶 (HRP) 结合使用。然而,它们的细胞内场景受到酶的膜不渗透特性的阻碍。在此,通过微乳液法制备了一种使用辣根过氧化物酶包裹的空心二氧化硅纳米球(命名为HRP@HSNs)进行细胞内活性氧检测的新方法,该纳米球具有令人满意的催化活性、细胞膜通透性和生物相容性。
这些 HRP@HSN 与选择性探针或靶向配体相结合,可以预见为特定细胞器或细胞类型中的 ROS 检测工具。因此,二氢罗丹明 123 偶联的 HRP@HSN 用于对活化的 RAW 264.7 巨噬细胞中的生理 H2O2 水平进行定性和半定量分析。我们设想这种封装活性酶的 HSN 可以与选择性探针和靶向配体结合,以检测特定细胞器或感兴趣的细胞类型中的 ROS。
背景
由自由基和非自由基分子组成的活性氧 (ROS),如超氧阴离子、过氧化氢、羟基自由基、单线态氧和过氧亚硝酸盐,在有氧代谢过程中不断产生。细胞 ROS 主要由线粒体电子传递链 (mETC) 产生,通常被酶(如超氧化物歧化酶、过氧化氢酶和过氧化物酶)和非酶(如维生素 A、C 和 E;尿酸盐;和胆红素)抵消) 抗氧化防御 [1]。然而,ROS 产生的不平衡会导致氧化应激和随后对 DNA、脂肪酸、蛋白质和其他细胞成分的损伤,可能导致糖尿病 [2]、癌症 [3]、心血管疾病 [4] 和神经退行性疾病[5] 如阿尔茨海默病和帕金森病。活细胞中的直接成像和 ROS 定量是非常理想的,但也非常具有挑战性。
荧光显微镜 [6, 7] 的进步已经允许在单细胞水平上开发 ROS 进化的无创测量和成像。为了检测 ROS,大多数探针被设计为测量荧光强度的变化或发射波长的变化(即,比率方法)在前荧光芳香分子氧化或掩蔽化合物脱保护为荧光产物后 [8]。在设计成功的探针时,对特定类型 ROS 的特异性很重要;例如,硼酸盐氧化被用作研究生命系统中过氧化氢化学的生物正交反应方法 [9]。为了探索 ROS 的时空动力学,我们生成了几种与带正电荷的鏻部分结合的基于硼酸盐的探针,用于线粒体靶向 [10, 11]。然而,它们在体内成像的潜力受限于它们在生物环境中的不稳定性、组织屏障的低渗透性以及通过泌尿系统从体内快速消除 [12,13,14]。为了克服这些问题,已经开发了一些策略,通过将额外的稳定结构化学接枝到探针上 [15](例如,三甘醇链),开发基于基因编码的荧光蛋白指示剂 [16],或应用基于反应的用于 ROS 分子成像的生物发光报告基因 [17] 或正电子发射断层扫描 (PET) 探针 [18]。此外,几项综合研究强调纳米制剂是一个重要的设计考虑因素,并证明基于纳米颗粒的探针可以提供机械见解和创新策略,以高特异性和灵敏度对活生物体中的 ROS 进行成像 [19,20,21,22]。具有高催化活性和独特底物选择性的酶也已被用作鉴定目标分析物的临床诊断工具。然而,游离酶缺乏持久稳定性和难以通过生物膜的渗透往往限制了它们在复杂生物环境中的应用。尽管应用电极不适用于细胞内测定或体内成像,但已经投入了相当多的努力来开发掺入辣根过氧化物酶 (HRP) 的生物传感器,以基于电化学方法测定 H2O2 [23, 24]。
在这项工作中,酶促纳米反应器由封装在 45 纳米空心二氧化硅纳米球中的 HRP 组成,通过油包水 (w/o) 微乳液途径合成,然后是温和的蚀刻工艺 [25]。以前,我们证明了这种中空纳米材料可以保持封装的酶和纳米催化剂的稳定活性,同时分别防止蛋白质水解和烧结 [26, 27]。在这项工作中,我们通过研究 HRP@HSNs 的酶包埋效率、负载能力、过氧化物反应性和选择性、细胞摄取、毒性和增殖效应,评估了它们作为细胞内生物传感器的潜在用途。使用二氢罗丹明 123 (DHR123) 作为底物,通常与 HRP 偶联以检测细胞内过氧化氢的产生,通过流式细胞术和荧光显微镜研究 HRP@HSNs 与水溶液中各种类型的 ROS 之间的相互作用。此外,还证明了将 HRP@HSN 与 DHR123 结合使用可以同时对佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA) 刺激的 RAW264.7 巨噬细胞中的生理 H2O2 水平进行成像和量化。综上所述,HRP@HSNs 的酶促纳米反应器具有在体内对 ROS 相关炎症细胞进行成像的潜力,并且封装的成分可以扩展到多种不同的酶 [28]、纳米颗粒 [26] 和用于协同应用的识别分子。
方法/实验
化学品和试剂
癸烷,n -己醇 (98%)、氢氧化铵 (NH4OH, 35%)、原硅酸四乙酯 (TEOS, 98%)、3-氨基丙基三甲氧基硅烷 (APTMS, 95%) 和异硫氰酸荧光素 (FITC) 异构体购自 ACROS。聚氧乙烯 (5) 异辛基苯基醚 (Igepal CA-520)、HRP VI-A 型 (HRP)、3,3'5,5'-四甲基联苯胺 (TMB)、柠檬酸、二甲亚砜 (DMSO) 和罗丹明 B 异硫氰酸酯 ( RITC) 购自 Sigma-Aldrich。 2-(4-碘苯基)-3-(4-硝基苯基)-5-(2,4-二磺苯基)-2H-四唑鎓购自Clontech。 DHR123 和 PMA 购自 Cayman Chemical。过氧化氢(H2O2,35%)购自昭和化学工业公司。叔丁基过氧化氢溶液(70% 的 H2O)购自 Aldrich。高氯酸铁 (II) (Fe(ClO4)2) 购自 Alfa Aesar。超纯去离子 (D.I.) 水由 Millipore Milli-Q Plus 系统生成。所有试剂均未经进一步纯化直接使用。
中空二氧化硅纳米球 (HSN) 的合成
如我们之前的研究[25, 29] 中所述,HSN 是通过反向微乳液系统合成的,并辅以选择性蚀刻方法。通常,20 mL 癸烷作为油相,1.63 mL CA-520 作为表面活性剂,以及 550 µL n 将作为辅助表面活性剂的 -己醇混合并用 2 厘米 PTFE 涂层搅拌棒以 650 rpm 磁力搅拌。之后,将 350 μL 的 D.I.在室温下将水加入混合物中,生成油包水 (w/o) 微乳液体系。接下来,在搅拌下加入 25 μL APTMS 乙醇溶液(200 μL APTMS 在 1.4 mL 无水乙醇中)和 100 μL TEOS。搅拌 10 分钟后,在 20°C 搅拌下将 250 μL 氨水(35wt%)引入系统。 10 小时后,加入 95% 乙醇使微乳液系统不稳定,并通过以 11,000 rpm 离心 20 分钟收集固体二氧化硅纳米粒子 (SSN)。为了获得 HSN,SSN 被暂停在 D.I.在 40°C 下搅拌 40 分钟的水。接下来,通过以 11,000 rpm 离心 20 分钟收集 HSN,并用 95% 乙醇洗涤数次。最后,将HSNs悬浮并保存在99.5%的乙醇中。
辣根过氧化物酶封装空心二氧化硅纳米球 (HRP@HSNs) 的合成
HRP@HSNs 是通过基于我们之前研究的方法合成的 [27, 28]。通常,合成类似于上述程序,不同之处在于 350 μL 的 D.I.水被 350 μL 的 HRP 水溶液(90 μL 10 mg/mL 的 HRP 溶液在 350 μL 去离子水中)代替。合成后,HRP@HSNs 保存在 D.I. 4°C 的水。
FITC-HSN 和 HRP@FITC-HSN 的合成
HSNs 和 HRP@HSNs 与掺入绿色荧光素染料(指定为 FITC-HSNs 和 HRP@FITC-HSNs)的合成与上述过程类似,不同之处在于乙醇 APTMS 溶液被 FITC-APTMS 溶液代替。通过将 10 毫克 FITC 和 200 微升 APTMS 与 1.4 毫升无水乙醇在室温下在黑暗条件下混合 18 小时来制备乙醇 FITC-APTMS 溶液。
HRP@HSNs的HRP诱捕效率和装载能力
首先,由 HRP(6 毫克在 500 微升去离子水中)和 RITC(3 毫克在 350 微升 DMSO 中)组成的混合物在黑暗条件下在 4°C 下搅拌 24 小时。之后,将混合物转移到由截留分子量为 12~14 kDa 的再生纤维素组成的透析膜上。然后,为了去除未反应的 RITC,将透析袋对 1 L D.I.水并轻轻搅拌 3 天。最后,利用RITC标记的HRP(指定RITC-HRP)合成了RITC-HRP@HSNs。
为了确定 HRP 负载能力,将 RITC-HRP@HSNs 溶解在 1 mL NaOH (1 M) 中 1 小时,并根据通过绘制荧光强度与RITC-HRP 的浓度。用日立 F-4500 仪器在 543 nm 激发波长和 550~650 nm 发射波长下测量荧光。 HRP@HSNs的HRP包封率和负载能力定义如下:包封率(%) =RITC-HRP@HSNs中RITC-HRP的质量/RITC-HRP的初始质量;负载能力 =HRP-RITC@HSNs中RITC-HRP的质量/RITC-HRP@HSNs的质量。
HRP 活性测定
为了检测过氧化物酶的活性,使用了 TMB 的显色底物。当使用过氧化氢作为氧化剂被 HRP 氧化时,TMB 可以转化为有色产物。首先,在磷酸盐和柠檬酸盐缓冲液(pH 5.2)中制备各种浓度的天然 HRP 和 HRP@HSN。然后,每个溶液补充有 50 μL TMB 溶液(20 μM DMSO)和 50 μL H2O2(20 μM 去离子水)。通过使用酶标仪(BioTek Synergy Hybrid Reader)测量 655 nm 处的吸光度来监测反应。由天然HRP的校准曲线计算封装在HSNs中的HRP的活性。
HRP@HSNs 对各种 ROS 的反应性分析
DHR123(20 μM)单独或与 HRP@HSN(50 μg/mL)混合在 100 μL DMEM 溶液(pH 7.4)中与各种类型的 ROS(100 μM)一起孵育。在前 120 分钟内每 5 分钟监测 530 nm (λex =488 nm) 的荧光发射。所研究的 ROS 如下获得:过氧化氢 (H2O2) 和叔丁基过氧化氢 (TBHP) 分别由市售的 32% 和 70% 水溶液制备。超氧化物 (O2 •− ) 由 DMEM 中的 10 mM 超氧化钾 (KO2) 储备液生成。羟基自由基 (•OH) 和叔丁氧基自由基 (•OtBu) 分别由 1 mM Fe(ClO4)2 与 100 μM H2O2 或 100 μM TBHP 反应产生。
细胞培养和活力测定
RAW264.7 小鼠巨噬细胞系从 ATCC 获得。 RAW264.7 细胞在含有 10% FBS、100 U/mL 青霉素和 100 μg/mL 链霉素 (Gibco) 的 DMEM 中保持在 37°C 和 5% CO2 气氛中。通常,2 × 10 5 将每孔 RAW264.7 细胞接种在 24 孔板中进行活力测定。 24 小时后,将细胞用 PBS 洗涤两次,并与不同量(0、50、100 和 200 微克/毫升)的纳米颗粒悬浮液在无血清 DMEM 中孵育 2 小时。对于细胞毒性测定,纳米颗粒处理的细胞用培养基洗涤两次,然后与 WST-1 试剂(Clontech)在 37°C 下孵育 2 小时。对于增殖测定,用纳米颗粒处理 2 小时后的细胞在常规生长培养基中生长 24 小时,然后与 WST-1 试剂一起孵育。通过活细胞产生的甲臜染料测定细胞活力,并使用酶标仪(Bio-Rad,680 型)测量 450 nm 处的吸光度,参考波长为 650 nm。
细胞摄取分析
RAW264.7 细胞在 1 × 10 6 每孔接种于六孔板过夜。然后,RAW264.7 巨噬细胞在无血清 DMEM 培养基中用不同量(0、50、100 和 200 μg/mL)的纳米颗粒悬浮液处理 2 小时。之后,细胞用PBS洗涤3次并用胰蛋白酶-EDTA溶液分离。通过流式细胞术检查 RAW264.7 巨噬细胞对纳米颗粒的吸收。利用台盼蓝猝灭吸附在细胞外膜上的纳米颗粒的荧光。
PMA 刺激的 RAW264.7 巨噬细胞中 ROS 产生的流式细胞术分析
通常,在用纳米颗粒处理 RAW264.7 巨噬细胞 2 小时后,将细胞用 PBS 洗涤 3 次,然后在无血清 DMEM 中与 20 μM DHR123 一起孵育 30 分钟。然后,RAW264.7 细胞用 PBS 洗涤,并与含有不同浓度 PMA 的培养基一起孵育 1 小时。洗涤后,收获RAW264.7巨噬细胞并通过FACS Canto II流式细胞仪进行分析。
定量分析
RAW264.7 细胞在 3 × 10 4 每孔接种 96 孔板进行半定量分析。在与 50 μL 的 100 μg/mL 纳米颗粒悬浮液在无血清 DMEM 中孵育 2 小时后,用 50 μL 含有不同浓度 PMA 的无血清 DMEM 和 20 μM DHR123 处理纳米颗粒处理的细胞。在 37°C 下 1 小时。同时,将 H2O2 的外标与 50 μg/mL HRP@HSN 混合,通过绘制荧光强度与 H2O2 浓度的关系来绘制校准曲线。用酶标仪(BioTek Synergy Hybrid Reader)在 488 nm 激发和 530 nm 发射下测量荧光强度。使用建立的校准曲线,计算了用不同量PMA刺激的RAW264.7细胞中H2O2的含量。
特征化
透射电子显微镜 (TEM) 图像是在 JEOL JEM-1200 EX II 上在 100 kV 下运行时拍摄的。图像是用 GatanOrius CCD 相机记录的。将样品分散在 95% 的乙醇中并滴在涂有碳的铜网上,然后风干并进行检查。为了验证空心球中的 HRP,将阴性染色样品在 1% 醋酸双氧铀 (UA) 水溶液中搅拌 1 小时,然后离心以去除剩余的 UA。最后,将样品分散在乙醇中并滴在铜网上进行成像。动态光散射 (DLS) 和 zeta 电位测量在 Zetasizer Nano ZS (Malvern, UK) 上进行。 RAW264.7细胞光学图像采用蔡司Axio Observer Z1倒置显微镜拍摄。
结果与讨论
HSN 和 HRP@HSN 的设计与合成
通常,根据我们之前的方法 [27, 28],HSN 和 HRP@HSN 是通过氨催化的溶胶-凝胶工艺结合油包水 (w/o) 微乳液系统合成的。方案 1 说明了 HRP@HSN 的合成。根据 TEM 图像(图 1),带有和不带有封装 HRP 的 HSN 显示平均直径为 45 nm(附加文件 1:图 S1)。 UA 染色清楚地显示 HRP@HSNs 内部的电子密度增强,但在 HRP@HSNs 外部未观察到染色(图 1b),表明 HRP 酶成功捕获在 HRP@HSNs 的内腔内。
<图片>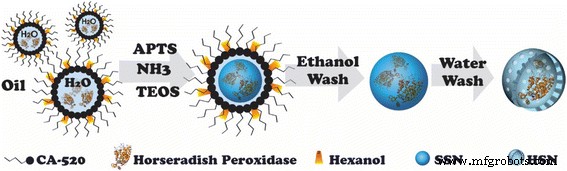
辣根过氧化物酶包裹的空心二氧化硅纳米球(HRP@HSNs)的合成流程图。 APTMS,3-氨基丙基三甲氧基硅烷; TEOS,原硅酸四乙酯; SSN,固体二氧化硅纳米颗粒
<图片>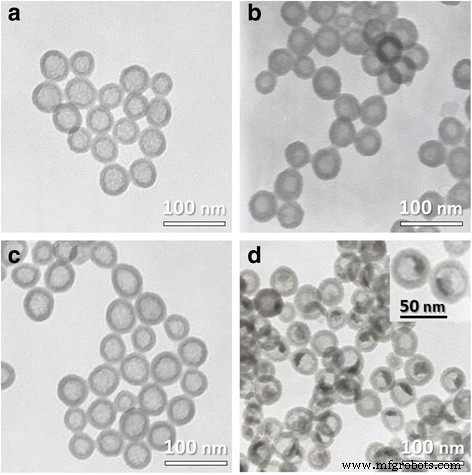
a 的 TEM 图像 空心二氧化硅纳米球 (HSN),b HSNs 用醋酸双氧铀染色,c 辣根过氧化物酶封装的 HSN(HRP@HSN)和 d HRP@HSNs 用醋酸双氧铀染色。插图:放大图
在室温下进行的 DLS 测量和 zeta 电位分析如表 1 所示。DLS 数据显示,HSN 和 HRP@HSN 在水(pH 值 ~ 6.5)中均具有正 zeta 电位,流体动力学直径为 188 ± 4 和 184 ± 6 nm分别在水中。然而,当纳米颗粒分散在无血清 DMEM 中时,HSNs 的流体动力学直径增加到 1767 ± 94 nm,HRP@HSNs 增加到 1598 ± 127 nm。这些表明 HSN 的聚集程度很小,但它们仍然很好地悬浮在媒体中。同时,在介质中测得的两种纳米颗粒的负 zeta 电位表明,来自生物环境的一些离子和生物分子可能已吸附到纳米颗粒表面 [30, 31]。在这种情况下,纳米粒子的正电荷表面被带负电荷的物质覆盖,通过静电相互作用迅速引起纳米粒子的聚集。为了减少非特异性聚集并促进纳米颗粒的胶体稳定性,将牛血清白蛋白 (BSA) 引入生物介质 [28]。随后,HSNs和HRP@HSNs的流体动力学直径分别显着降低至197 ± 43和195 ± 19 nm。
HRP@HSNs的HRP诱捕效率和装载能力
为了研究 HRP 截留的效率和负载能力,制备了荧光染料 (RITC) 标记的 HRP(指定为 RITC-HRP)。 RITC-HRP@HSNs 的荧光强度是通过将纳米颗粒悬浮在 1 M NaOH 中来测量的,封装的 RITC-HRP 的量根据通过绘制荧光强度与天然 RITC-HRP 浓度而建立的校准曲线来确定在相同条件下(附加文件 1:图 S2)。为了研究酶浓度对截留效率和负载能力的影响,将三种不同量的 HRP(11.1、22.2 和 33.3 nmol)引入到合成中。值得注意的是,在这个浓度范围内,无论引入多少酶,三种情况下酶的包封率都在6%左右。这种低效率可能是因为只有一小部分微乳液液滴成核并成长为 HSN;大多数微乳液液滴没有成核,并保持在 ~ 8 nm 的小尺寸 [25]。未来的工作可能需要提高装载效率。然而,当使用 33.3 nmol HRP 时,HRP@HSNs 的 HRP 负载能力逐渐增加到 12.5 ± 1.2 μg HRP/mg HSN(附加文件 1:表 S1)。这表明HRP负载能力可以通过反应中存在的酶量来控制。
HSN 和 HRP@HSN 的细胞毒性和细胞摄取
为了评估 HSN 和 HRP@HSN 的体外细胞毒性,通过 WST-1 测定检查细胞活力。如附加文件 1:图 S3 中所示,在纳米颗粒处理 2 小时或 2 小时之后再培养 24 小时后,未观察到 RAW264.7 细胞增殖的显着变化。无论HSNs内部是否存在HRP,在指定时间点均未发现二氧化硅纳米颗粒对细胞线粒体功能产生明显影响。
接下来,分别制备了 FITC 偶联的 HSN 和 HRP@HSN,以研究纳米颗粒对 RAW264.7 标记的浓度影响。流式细胞术结果(附加文件 1:图 S4)显示 RAW264.7 细胞在无血清培养基中成功地用不同浓度的 FITC-HSN 和 HRP@FITC-HSN 标记了 2 小时。在这两种情况下,都发现标记效率呈剂量依赖性增加,超过 80% 的 RAW264.7 细胞通过暴露于浓度> 50 μg/mL 的纳米颗粒 2 小时而被标记。 HRP@HSNs具有培养时间短、细胞内标记效率高、纳米粒子剂量相对较低、无细胞毒性等特性,适用于ROS的细胞内检测。
HRP@HSNs 对各种 ROS 的反应性
根据使用 TMB 作为底物的 HRP 酶活性测定,在随后将 HRP 封装到 HSN 中后,大约 40% 的初始酶活性仍然存在。观察到的封装酶比活性的降低(每单位时间每单位酶转化的底物摩尔数)可能是由于传质限制造成的,当底物穿过二氧化硅壳朝向 HRP 时会发生这种情况[32]。然而,封装策略提供了额外的特性,例如,多孔二氧化硅壳可以保护 HRP 免受蛋白水解,同时允许小分子反应物和产物的运输 [26, 27]。综上所述,通过掺入荧光探针(DHR123)评估的 HRP@HSNs 对 ROS 的反应性可能是由于纳米颗粒的亲和力以及 HRP 对 ROS 的固有特性的综合作用。
无细胞系统用于产生各种生物相关的 ROS,包括过氧化氢 (H2O2)、TBHP、羟基自由基 (•OH)、叔丁氧基自由基 (•OtBu) 和超氧化物 (O2• − )。首先,在不存在和存在 HRP 或 HRP@HSN 的情况下,将 DHR123 与一组 ROS 一起孵育,然后测量产品罗丹明 123 (R123) 的荧光强度。如图 2 所示,无论采用哪种类型的 ROS,荧光强度都以时间相关的方式(30、60、90 和 120 分钟)进行测量。然而,各种 ROS 之间强度的明显差异取决于 DHR123 的内在特性。一方面,与之前的研究 [33] 一致,图 2a 显示 H2O2 和 O2• − 可将 DHR123 氧化为 R123。此外,与其他 ROS 相比,DHR123 对 •OtBu 和 •OH 自由基表现出更高的反应性。随着 HRP 的催化活性,在天然 HRP 和 HRP@HSN 存在下观察到荧光强度显着增加,如图 2b、c 所示。值得注意的是,在相同反应时间,天然 HRP 的荧光强度高于 HRP@HSNs,与其观察到的酶活性呈正相关。
<图片>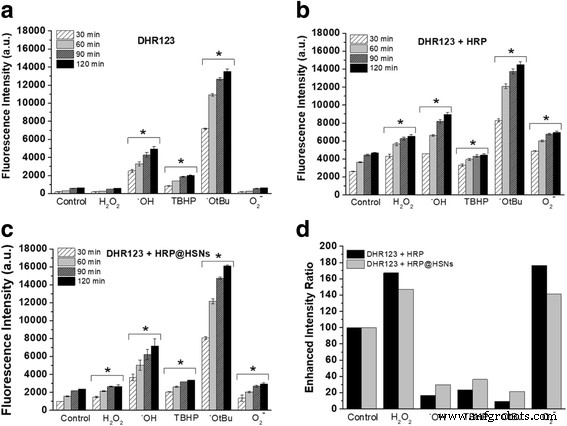
一 –c 选定的活性氧 (ROS) 与 a 反应的时间依赖性荧光强度 二氢罗丹明 123 (DHR123),b DHR123 + 辣根过氧化物酶 (HRP) 和 c DHR123 + 辣根过氧化物酶封装的 HSN(HRP@HSN)。 d 选定 ROS 与 DHR123 + HRP 和 DHR123 + HRP@HSN 在 1 小时时的反应强度比增强。显示的数据是 20 μM DHR123、400 ng/mL HRP、50 μg/mL HRP@HSN 和 100 μM ROS。 (*p <0.05 vs 对照组相应时间点)
为了允许在各种 ROS 之间进行直接比较,选择了 60 分钟时间间隔的数据并报告为相对于对照标准化的相对荧光强度(附加文件 1:图 S5)。通过将 DHR123 + HRP 或 DHR123 + HRP@HSNs 的相对荧光强度除以 DHR123,显示了对增强强度比的后续分析(图 2d)。在两种含 HRP 的情况下,各种 ROS 的强度比增强趋势相似,DHR123 对 H2O2 和 O2 的反应性显着增加• - 观察到,表明封装的HRP具有高度的内在酶活性,并且HRP@HSNs的二氧化硅壳允许小分子的运输进行选择性生物催化。
使用 HRP@HSNs 检测细胞内 ROS
为了评估细胞内 HRP@HSNs 的 ROS 检测功能,将 RAW264.7 巨噬细胞与 HRP@HSNs 孵育 2 小时,然后洗涤,然后与 DHR123 (20 μM) 孵育 30 分钟。随后,洗涤细胞并用 PMA (1 μg/mL) 再处理 1 小时。众所周知,用 PMA 刺激巨噬细胞会产生超氧化物,超氧化物歧化酶或自发歧化将其歧化为过氧化氢 [34,35,36]。因此,PMA 可以作为刺激剂在 RAW264.7 巨噬细胞中产生 H2O2,以评估 HRP@HSNs 的细胞内 H2O2 传感能力。如图 3a 所示,单独培养和与 HSN 一起培养的 RAW264.7 巨噬细胞的两种情况在流式细胞术分析中都显示出弱荧光,表明未受刺激的细胞产生的 ROS 基础水平较弱,其中没有显着的 ROS 在HSN 的存在。此外,用HRP@HSNs处理的细胞显示出显着的强度增加(图3a),表明递送的HRP@HSNs在细胞内具有额外的催化活性。
<图片>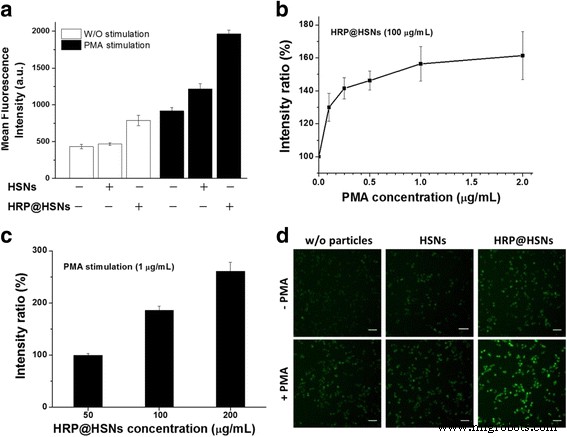
一 RAW264.7 巨噬细胞的流式细胞术分析,在存在和不存在纳米粒子的情况下,使用和不使用佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA) 进行刺激。 b PMA 和 c 辣根过氧化物酶包裹的 HSNs (HRP@HSNs) 浓度依赖性地改变了 RAW264.7 巨噬细胞的荧光。 d RAW264.7 巨噬细胞在指定条件下的代表性荧光图像。比例尺 50 μm
对于刺激实验,与未刺激的细胞相比,经 PMA 处理的细胞通常产生高出两倍的 R123 荧光水平。此外,用 HRP@HSNs 处理的细胞具有最高水平的荧光,其次是 HSNs,然后是单独的细胞。值得注意的是,与对照相比,用 HSN 处理受刺激的 RAW264.7 巨噬细胞导致荧光强度略有增加。这一结果表明细胞应激反应被极快地触发,并且对外部刺激敏感,包括暴露于纳米颗粒 [37]。此外,PMA(0.1、0.25、0.5、1 和 2 μg/mL)和 HRP@HSN(50、100 和 200 μg/mL)均以剂量依赖性方式诱导 R123 的表达,如图所示. 3b, c.
根据流式细胞术分析,图 3d 显示了 RAW264.7 巨噬细胞在存在和不存在纳米颗粒的情况下使用和不使用 PMA 刺激的代表性荧光图像。该系统能够可视化 RAW264.7 细胞中的内源性 H2O2 生成,在用 HRP@HSNs 处理的细胞中观察到最弱的荧光强度,然后是 PMA 刺激。如图 4a 所示,在刺激剂 PMA 或外源性 H2O2 存在下,RAW264.7 巨噬细胞的细胞活力通过 WST-1 测定进行了检查。尽管 ROS 与细胞凋亡有关 [38],但在指定的时间点仅对细胞活力产生很小的影响,这使得以下半定量分析具有实际意义。
<图片>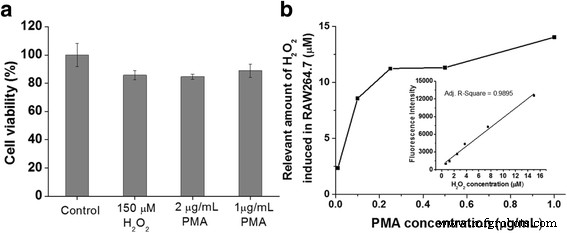
一 在外源性 H2O2 处理或用佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA) 刺激 1 小时后,对 RAW 264.7 巨噬细胞进行 WST-1 测定。 b 在辣根过氧化物酶封装的空心二氧化硅纳米球 (HRP@HSNs) 和二氢罗丹明 123 (DHR123) 存在下,检测 RAW264.7 巨噬细胞在不同浓度的 PMA 兴奋剂下内源性产生的 H2O2 浓度。插图:从 H2O2 与 HRP@HSNs 和 DHR123 混合的外标获得的校准曲线
Application of HRP@HSNs In Vitro for Quantitative Analysis of H2O2
To evaluate the capacity of HRP@HSNs for quantifying endogenous hydrogen peroxide produced in PMA-stimulated RAW264.7 cells, a calibration curve from the exogenous H2O2 experiment, with a detection range of 0.625~15 μM, was established by microplate measurements (Fig. 4b, inset). The standard calibration curve appears to be linear as expected. Then, RAW264.7 cells were treated with 100 μg/mL of HRP@HSNs for 2 h, followed by co-incubation with various concentrations of PMA and 20 μM of DHR123 at 37 °C for 1 h. After that, the concentration of H2O2 endogenously produced by PMA-stimulated RAW264.7 cells was determined by measuring the fluorescence intensity, followed by conversion using the established calibration curve. Notably, because most of the HRP@HSNs were uptaken within the cells, the H2O2-triggered fluorescence of R123 could be attributed to intracellular enzyme-catalyzed reactions rather than the extracellular contribution. Although H2O2 is able to diffuse across biomembranes, due to its limited diffusion and rapid enzymatic consumption inside cells, concentration gradients of H2O2 are formed across membranes [39, 40]. Typically, under normal physiological conditions, H2O2 has an extracellular concentration estimated at 10 − 7 ~10 − 6 M, which is about 10-fold higher than that observed in intracellular fluid [1, 41, 42]. In pathological conditions, extracellular concentrations of H2O2 are in the range of 10~50 μM and are additionally elevated to as high as 10 − 4 M in apoptosis [1]. As shown in Fig. 4b and Additional file 1:Table S2, endogenous hydrogen peroxide caused by PMA-stimulated RAW264.7 cells was created in a dose-dependent manner and produced at levels of about 10 μM when the concentration of PMA used exceeded 0.25 μg/mL. Taken together, these results indicate that HRP@HSNs were capable of detecting semi-quantitatively endogenous the concentration of hydrogen peroxide of RAW264.7 macrophages under oxidative stress conditions.
Conclusions
In summary, we have demonstrated that hollow silica nanospheres encapsulating HRP can be synthesized via a microemulsion-templating system and act as intracellular fluorescent ROS sensors. The shells of HRP@HSNs are permeable to small molecules, such as the enzyme substrates, which allows them to react with large enzyme payloads in the hollow cavity. Both the effective intracellular delivery and satisfactory catalytic activity of HRP@HSNs significantly enhance reduction-triggered fluorescence and constitute the ability of semi-quantitative measurements of endogenous H2O2 in RAW264.7 macrophages under oxidative stress conditions.
Because the concentration and location of H2O2 in eukaryotic cells strongly rely on the types of cells, and cellular compartments [1], specific targeting of tumor cells or organelles could further be achieved by surface modification of HRP@HSNs with monoclonal antibodies or peptides. Also, non-enzymatic H2O2 detection could be realized by replacing the interior nanoreactors of HRP with nanoparticles [43, 44] or boronate-based fluorescent probes [42, 45]. Future efforts should be devoted to maximizing the sensitivity and specificity for H2O2 as well as enabling more informative designs of next-generation nanomaterials. Such hollow capsules could be a promising platform for modern nanomedicines that aims to simultaneously image, sensing, and deliver therapeutic molecules specifically to defective cells.
缩写
- APTMS:
-
3-Aminopropyltrimethoxysilane
- BSA:
-
Bovine serum albumin
- DHR123:
-
Dihydrorhodamine 123
- DLS:
-
动态光散射
- FITC:
-
Fluorescein isothiocyanate
- HRP:
-
Horseradish peroxidase
- HSNs:
-
Hollow silica nanospheres
- Igepal CA-520:
-
Polyoxyethylene (5) isooctylphenyl ether
- mETC:
-
Mitochondrial electron transport chain
- PET:
-
Positron emission tomography
- PMA:
-
Phorbol 12-myristate 13-acetate
- R123:
-
Rhodamine 123
- RITC:
-
Rhodamine B isothiocyanate
- ROS:
-
活性氧
- SSN:
-
Solid silica nanoparticles
- TBHP:
-
Tert-butyl hydroperoxide
- TEM:
-
Transmission electron microscopic
- TEOS:
-
Tetraethyl orthosilicate
- TMB:
-
3,3′5,5′-Tetramethylbenzidine
纳米材料
- IBM 和 Warwick Image 首次获得高反应性三角形分子
- 将活性氧种类的毒性调整到高级肿瘤治疗中
- 用贵金属纳米粒子装饰的电纺聚合物纳米纤维用于化学传感
- 具有分层多孔结构的单分散碳纳米球作为超级电容器的电极材料
- 用于细胞内蛋白质递送的二氧化硅纳米颗粒:一种使用绿色荧光蛋白的新型合成方法
- 用于高效光催化制氢的 ZnO@TiO2 空心球的分级异质结构
- 用于超灵敏葡萄糖传感的介孔氧化镍 (NiO) 纳米瓣
- 在含有 GdVO4:Eu3+ 纳米颗粒及其与亚甲蓝复合物的水溶液中产生活性氧物质
- 单独用二氧化钛包覆二氧化硅并用海藻酸钠改性作为重金属离子吸附剂
- 结合绿原酸对硒纳米颗粒在体外抑制淀粉样蛋白 β 聚集和活性氧物种形成的增强作用
- 用于人体汗液传感的淀粉纸摩擦纳米发电机
- 用于高灵敏度无酶葡萄糖传感器的 Ni(OH)2 空心多孔结构的合理设计


