用于靶向乳腺癌成像的多模式可生物降解肿瘤微环境敏感纳米粒子
摘要
充气超声(US)造影剂在体内容易塌陷,气体容易溢出,限制了超声成像的有效性。为了解决这个问题,开发了一种可注射的产气多模式系统,该系统携带 MR 阴性造影剂 Fe3O4、荧光染料 Cy5.5 和 CO2 释放供体 (Na2CO3)。纳米粒子可以在体内的酸性肿瘤组织中持续产生二氧化碳(CO2)气体,在超声成像下给肿瘤一个强烈的回波信号。此外,纳米粒子对肿瘤组织的 MR 和荧光成像具有出色的效果。结果表明,这种 pH 响应 NP 系统在 MR/US/荧光成像中提供了良好的效果。本研究为多模式肿瘤成像提供了有益的参考。
介绍
在临床实践中,微泡主要用作超声造影剂,用于对各种器官和血管进行实时成像 [1,2,3]。传统的超声造影剂通常由包裹空气或全氟化碳气体的脂质或蛋白质等材料组成。由于微泡缺陷的快速扩散,封装在微球中的气体在血液中的稳定性低,半衰期短[4,5,6]。此外,由于充气微泡的粒径通常较大(约1~8 μm),因此微泡难以通过组织外渗渗透到宿主肿瘤环境中。因此,目前微米级气泡在血管内成像中的应用是有限的[7]。理想的超声造影剂通常应具有通过组织血管空间运输的最佳尺寸、足够的声学效应持续时间、良好的靶向性和生物相容性以及易于从体内排泄 [8, 9]。 “产气纳米颗粒”的概念在先前的研究中被提出,这种纳米颗粒有可能用于超声造影成像 [10,11,12]。这些产生气体的纳米粒子在性能上优于目前的充气微泡,并且持续产生的气体可以实现强烈的超声成像。产气纳米颗粒具有增强渗透性和滞留性,可在血液中稳定循环并在肿瘤组织中有效蓄积[13, 14]。
通过传统的成像方法,如磁共振成像 (MRI)、计算机断层扫描 (CT) 和超声,检测微小和隐匿的肿瘤仍然是一个挑战,这些方法受到采集时间长、辐射剂量高和灵敏度差的限制[15]。 , 16]。需要整合不同的成像方法,发展多模态成像技术,以实现癌症早期检测的整合协同[17,18,19]。超顺磁性氧化铁 (Fe3O4) 纳米颗粒可用作 T2 加权成像中的负 MRI 造影剂 [20, 21]。 Fe3O4 具有吸引人的整体特性,包括粒径小、渗透性强、磁化强度高、新陈代谢好、毒性相对较低 [22, 23]。用于早期癌症 MRI 诊断的 Fe3O4 造影剂由于其高弛豫和对比度而被广泛研究 [24,25,26]。此外,实时荧光成像具有出色的分辨率,是确定肿瘤分期、指导肿瘤切除和监测治疗效果的一种有价值的方法[27, 28]。
在本文中,这些纳米颗粒主要由聚(乳酸-乙醇酸共聚物)(PLGA)包裹,PLGA 已被美国食品和药物管理局(FDA)批准用作生物安全材料 [29, 30]。 PLGA 颗粒用 RGD 肽修饰,使其能够与乳腺癌细胞表面的 αvβ3 整合素结合,并用 Cy5.5 作为荧光染料进行体内成像,并用 Fe3O4 封装以充当 T2 阴性造影剂在 MRI 中(方案 1a)。由于肿瘤组织糖酵解上调,可以在细胞外环境中产生更多的乳酸和质子,因此肿瘤组织的pH值(6.8-7.2)低于正常组织的pH值(pH 7.4)[31,32,33] .因此,我们在 PLGA 中设计了碳酸钠 (Na2CO3),以在肿瘤组织的较低 pH 值下产生 CO2 气泡,用于超声成像。为了验证它们在肿瘤成像中的应用前景,通过三种成像模式系统地表征了这些用于体外成像的多模式纳米粒子的综合特性,包括它们的细胞毒性、靶向特异性和在肿瘤组织中的生物分布。
<图片>
一 Fe3O4/Na2CO3 @PLGA/Cy5.5/cRGD NPs 通过靶向积累到肿瘤中并在酸性肿瘤组织中产生 CO2 气泡,然后对乳腺癌进行三模态 MR/US/FI 成像的功能示意图。 b Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs的制备示意图
结果与讨论
Na2CO3/Fe3O4 @PLGA/Cy5.5/RGD NPs 的合成和表征
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 被设计为 RGD 靶向的多模式造影剂,通过可生物降解的化学键封装 PLGA 的生物相容性聚合物和整合素靶向剂(方案 1b)。
透射电子显微镜图像显示 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 是透明的球体,在壳中可见均匀分散的氧化铁颗粒(图 1a)。通过动态光散射测量纳米颗粒的平均流体动力学尺寸为 117.6 nm,平均多分散指数为 0.234(图 1b)。通过 zeta 电位测量证实 NP 的表面电荷为 - 21.7 mV(图 1c)。荧光光谱测量显示Na2CO3/Fe3O4@PLGA/Cy5.5/RGD在685 nm处具有最大发射波长,表明Cy5.5成功封装在PLGA核心中(图1d)。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD 和游离 Fe3O4 NPs 的饱和磁化强度值分别等于 32.6 和 42.5 emu/g(图 1e)。这些发现表明纳米颗粒在室温下具有超顺磁性。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD的FITR光谱表明N-H伸缩振动和-OH吸收峰出现在3432 cm -1 .此外,我们发现了一个增强 (1628 cm −1 ) 的 C =O 伸缩振动。与非靶向NPs相比,特征峰(羧基)在1735 cm -1 目标 NP 的数量显着减少。结果表明,微球表面的羧基与RGD肽上的氨基键合。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs的体外结合如图1f所示。
<图片>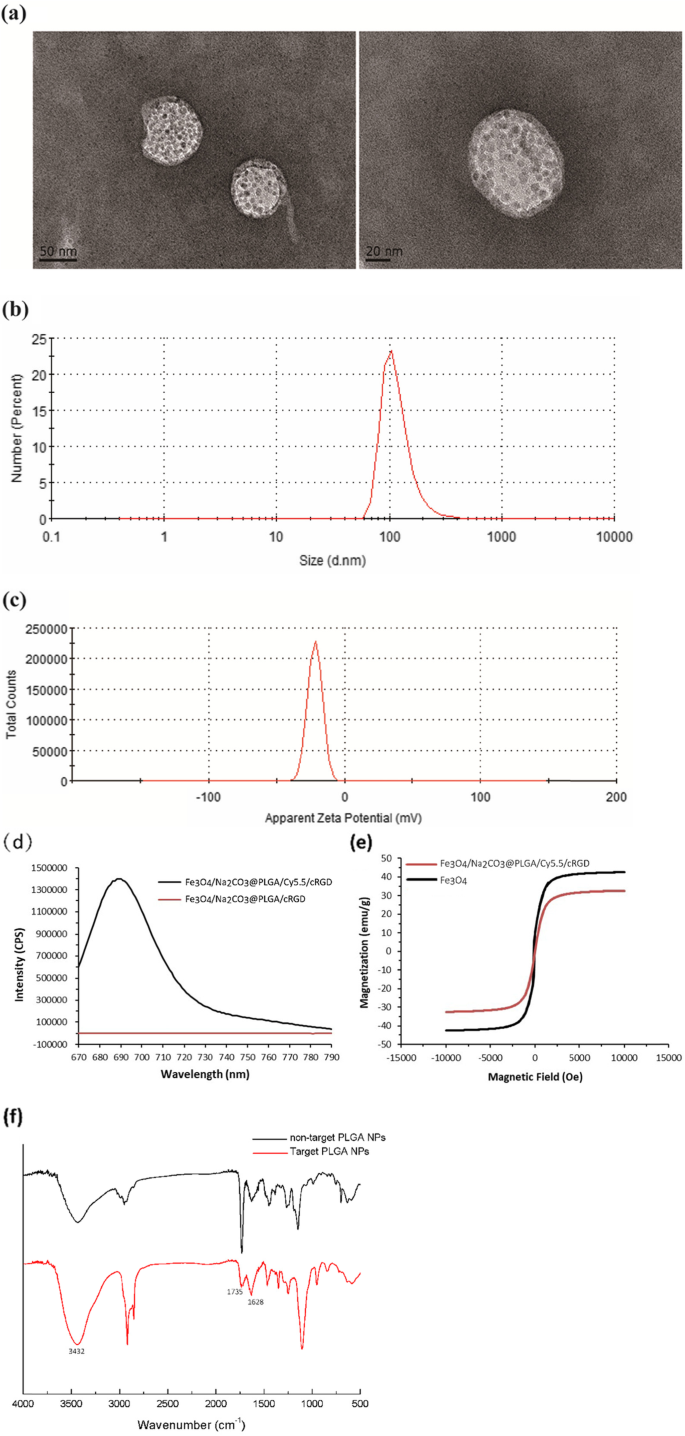
TEM 图像 (a ) 尺寸分布 (b ) Zeta 电位 (c ) Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs。 d Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD 和 Fe3O4/Na2CO3@PLGA/cRGD NPs 的荧光发射光谱。 e Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs和Fe3O4 NPs的磁滞曲线。 f 靶向Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD和非靶向PLGA NPs光谱的FTIR
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的体外结合
αvβ3 整合素通常在乳腺癌肿瘤内皮细胞上高表达,可促进肿瘤转移 [33,34,35,36]。 MDA-MB-231细胞αv整合素表达的细胞免疫荧光远高于MCF-7细胞; A549 细胞作为阳性对照(图 2a)。通过 CLSM 研究了 NPs 的细胞摄取(图 2b)。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 对 MD-MB-231 细胞的结合率比非靶向 NPs 高得多。荧光图像还显示Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs与细胞质结合,合并图像显示与αv整合素的表达位置相同[37, 38]。
<图片>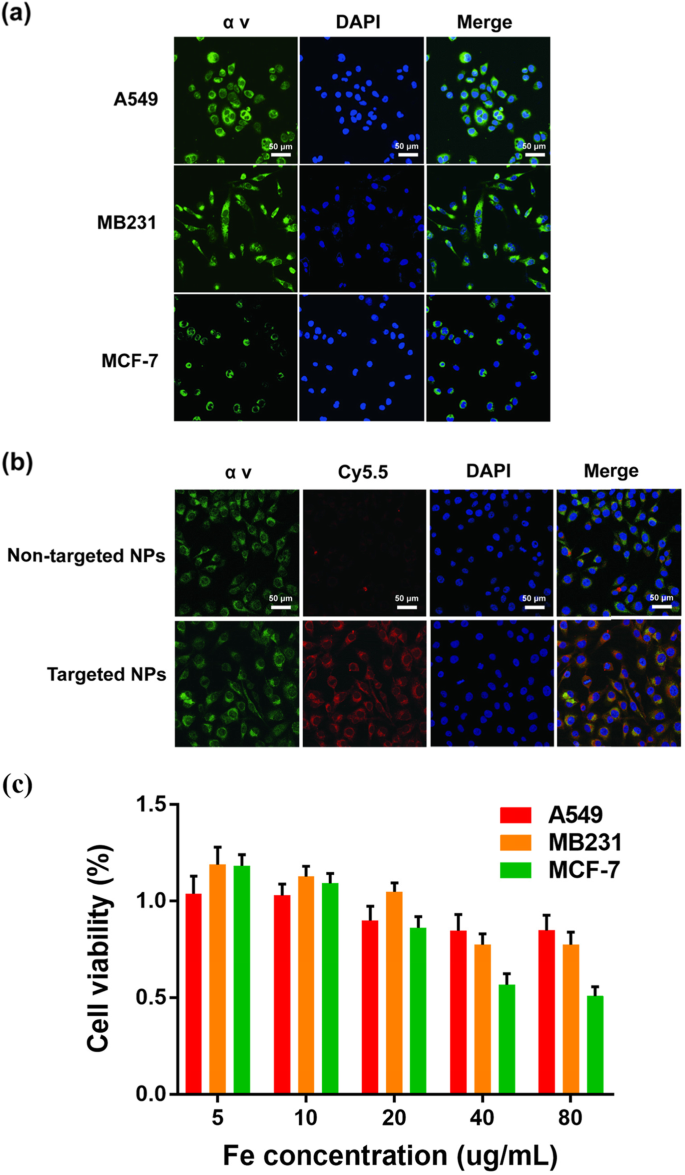
一 αv 整合素在 MB231、A549 和 Mcf-7 细胞上表达的共聚焦荧光图像。蓝色和绿色分别代表 DAPI 和 αv 荧光。 b MB231 细胞与靶向 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs 和非靶向 NPs 孵育的共聚焦荧光图像。蓝色、红色和绿色分别代表 DAPI、Cy5.5 和 α v 荧光。 c 不同浓度Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs孵育MB231细胞的相对活力
细胞毒性试验
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的体外细胞毒性在 MDA-MB-231 细胞中使用 CCK8 测定进行评估,而用 NPs 处理的 A549 和 MCF-7 细胞用作对照(图 2c) .在5-80 μg/mL的Fe浓度范围内,A549和MB231细胞的细胞活力没有明显降低,均在70%以上。相比之下,当 Fe 浓度高于 40 μg/mL 时,MCF-7 细胞的细胞活力显着降低至约 50%。 CCK8结果表明Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs在给定浓度范围内对MDA-MB-231细胞的细胞毒性显着降低。
体外对比成像
我们使用琼脂凝胶体模来研究 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 在不同 pH 值下的体外性能(图 3a)。与 pH 7.2 相比,Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的超声对比图像在弱酸性 pH (pH 6.8) 下显着增强,这可能是因为 pH 7.2 没有产生足够的 CO2 气泡进行超声成像。相比之下,当 NPs 处于弱酸性环境中时,可以产生足够的气泡用于超声成像。这一特征与肿瘤相关,肿瘤在体内表现出高度的组织异质性和不同的 pH 水平 (pH 6.8-7.2) [32, 39, 40]。然后分析超声图像的信号强度(图 3b)。非靶向 NP (pH =7)、非靶向 NP (PH =5)、靶向 NP (PH =7) 和靶向 NP (PH =5) 组的信号强度比相对于空白组分别为112%、145%、167%和178±4%,这清楚地表明靶向NP组(PH=5)的US信号最强。
<图片>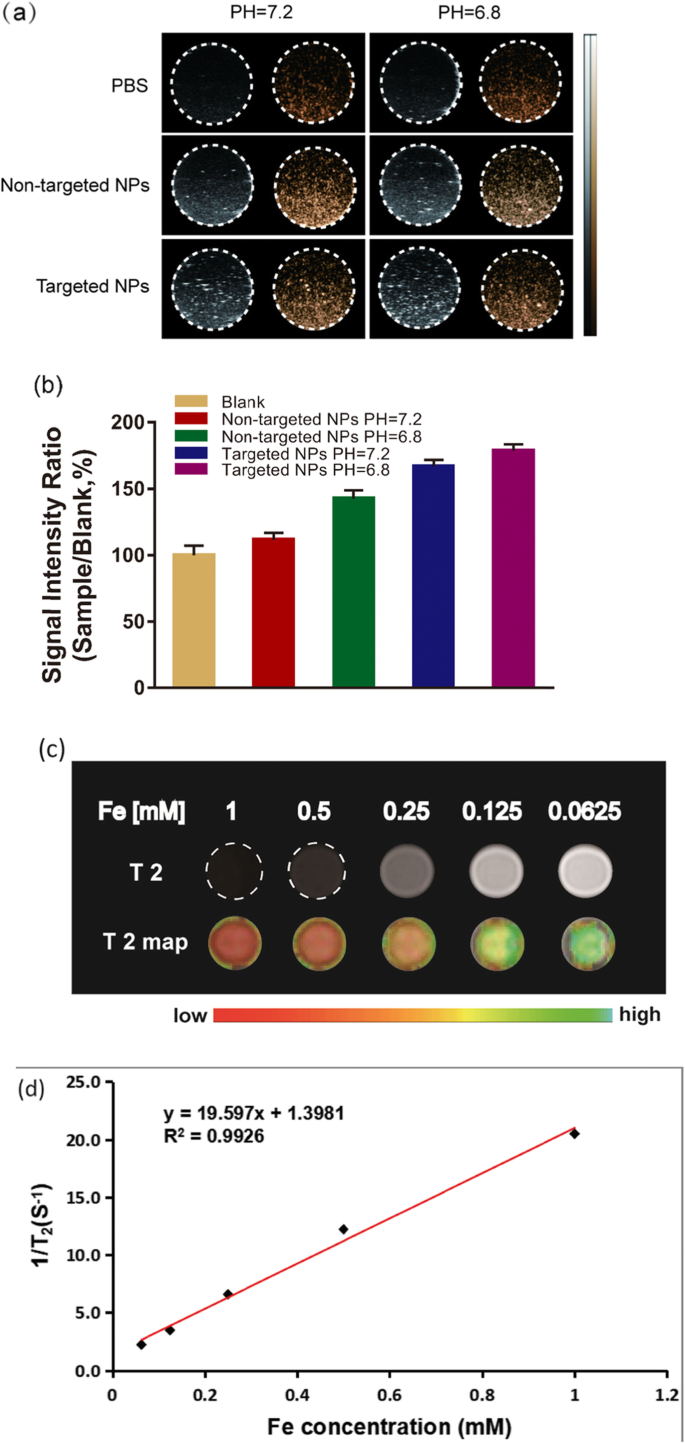
一 在不同 pH 值(7.2 和 6.8)下记录的靶向 NPs 和非靶向 NPs 的超声图像,PBS 作为对照。 b 信号强度率以sample/blank计算,sample代表目标和非目标NPs的回波强度,blank代表PBS的回波强度。 c 具有不同 Fe 浓度(0.0625、0.125、0.25、0.5 和 1 mM)的 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs 的 T2 加权 MR 图像。 d 横向相对系数 (r2) 为 19.597 mM -1 s −1 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs
对于体外 MRI 研究,随着 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 中 Fe 浓度的增加,T2 加权信号强度显着降低,表明这些 NPs 有可能用作 T2 MR造影剂(图 3c)。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs的横向弛豫率(r2)为19.597 mM -1 s −1 .尽管 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的横向弛豫率 (r2) 低于许多其他 MRI 超顺磁剂,但 Fe3O4 的成分可以增加 r2,是 r2 的 2.94 倍临床使用的SPIO颗粒。
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs的超声对比成像
为了证明 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 在肿瘤超声成像中的潜力,我们对乳腺癌异种移植裸鼠进行尾静脉注射 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs,并监测超声图像作为时间的函数(图 4a)。注射前,记录肿瘤、肝脏和皮下区域的图像。注射后立即,肿瘤组织区域未显示任何对比度增强。注射后30 分钟开始观察到肿瘤面积的增强,并持续90 分钟。体内超声结果表明,Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs在酸性肿瘤组织中产生了足够的气泡,产生了超声成像所需的回声反射率。作为对照,我们还在注射靶向 NP 后的不同时间获得了肝脏和皮下组织的图像。整个观察期间,皮下注射区未见明显强化,随时间推移逐渐减弱的肝脏强化明显低于肿瘤(图4b)。该结果表明,在生理pH值下在体内循环的Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs不会产生大量用于超声对比度增强的CO2气泡。
<图片>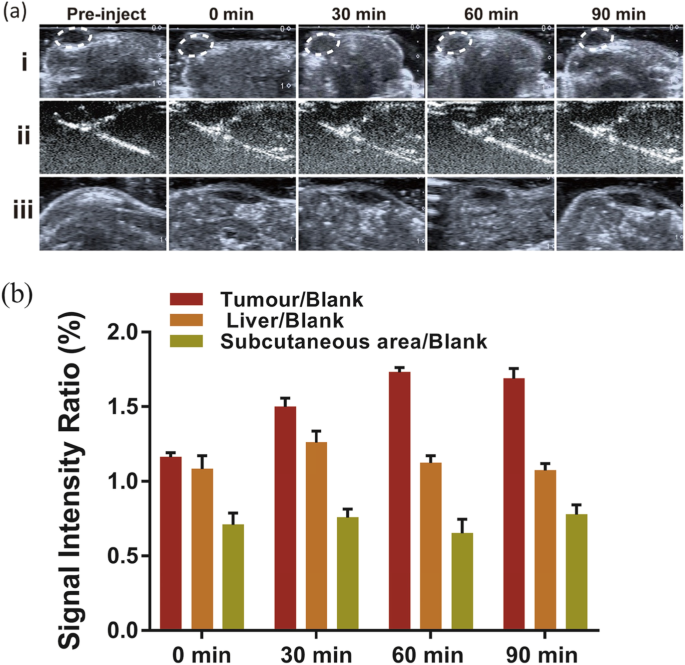
一 注射Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs后不同时间肿瘤、肝脏和皮下区域的体内超声成像。 b 回声强度率随时间的变化以组织/空白计算,组织代表肿瘤、肝脏或皮下区域的回声强度,空白代表注射前的回声强度
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的 MRI
对于体内 MRI,为了证明 NPs 可用于肿瘤特异性成像,将 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 直接注射到肿瘤和肌肉中。结果表明,注射靶向NPs后,肿瘤区域的T2-MR对比度显着降低,信号强度从注射后0 min时的8875显着降低到注射后120 min时的5972(图5a,b)。然而,注射相同量的纳米颗粒后,皮下肌肉区域的 T2 信号下降幅度要低得多。这一发现证明了 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 与超敏整合素靶向 T2-MR 造影剂用于肿瘤靶向成像的有效性。在尾静脉注射组中,T2-MR 成像也显示注射后 24 h 肿瘤对比度明显降低,表明 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的肿瘤高积聚(图 5c) , d)。此外,在肝脏和肾脏中观察到 T2 信号降低,表明 NPs 中的铁离子可以从体内迅速清除。因此,MRI显示PLGA包裹的Fe3O4纳米颗粒通过增强渗透性和保留(EPR)效应表现出有效的被动肿瘤靶向,尤其是RGD介导的靶向作用,但可以在体内分解并迅速排出体外。
<图片>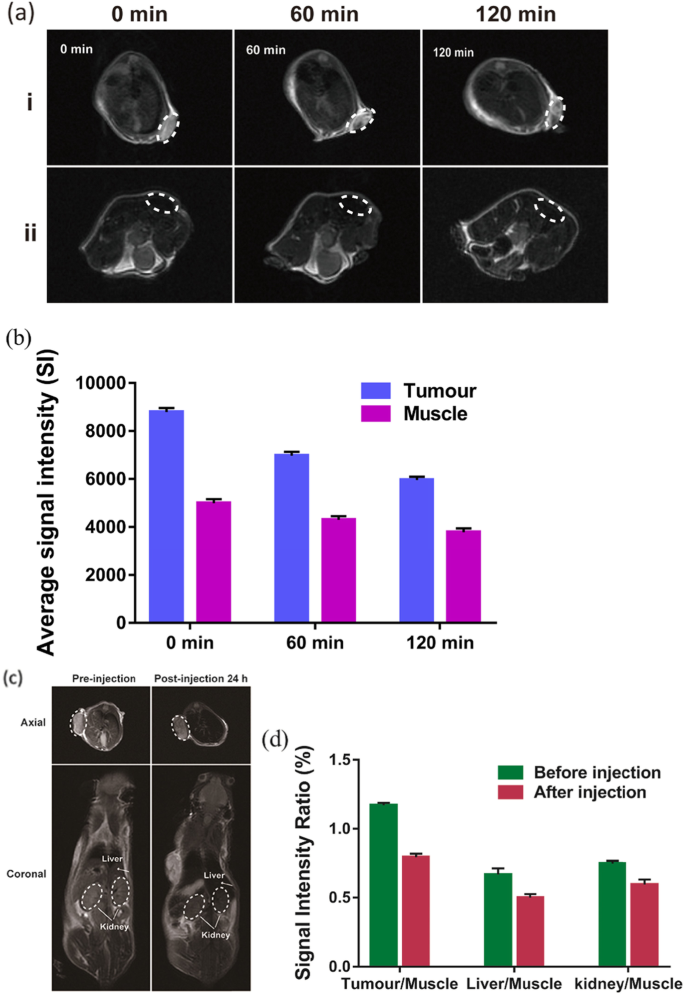
一 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs注射前后正常和肿瘤皮下组织的体内T2-MR图像。 b 注射 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs 在肌肉和肿瘤中的平均信号强度。 c 静脉注射 Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs 前后 MDA-MB-231 荷瘤小鼠轴向和冠状的 T2-MR 图像。 d 信号强度比以组织/肌肉计算,组织代表注射靶向NPs前后肿瘤、肝脏和肾脏的信号强度,肌肉代表同时肌肉的信号强度
荧光成像和组织学
将 200 微升 NPs 静脉注射到小鼠体内,用于体内荧光成像。在注射RGD靶向NPs的组中,Cy5.5的荧光信号在肿瘤区域逐渐增强,注射后4 h达到峰值,表明Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs可以有效积累在肿瘤中。在非靶向组中,NPs在注射后分布于全身并迅速清除,并且它们没有长时间在肿瘤中积聚(图6a)。然后解剖小鼠,收集主要器官和肿瘤用于体外荧光成像,这表明靶向 NP 的肿瘤高吸收(图 6b、c)。 Cy5.5在注射靶向NPs小鼠肿瘤中的荧光强度是注射非靶向NPs小鼠的1.5倍。
<图片>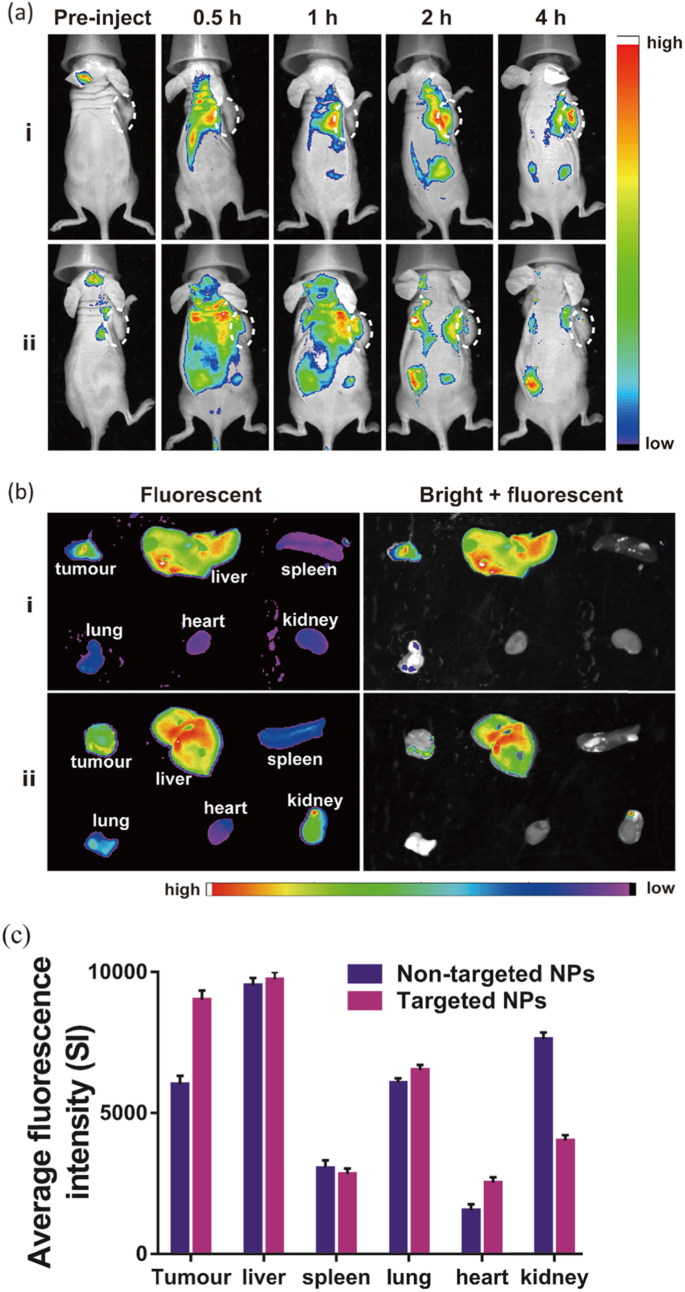
一 注射靶向和非靶向 NPs 后,动物在注射后 0、0.5、1、2 和 3 h 的体内荧光荧光成像。 b 从动物身上收集的肿瘤和主要器官(肝、脾、肺、心脏和肾)的离体荧光图像。 c 各器官和肿瘤的平均荧光强度
此外,通过冷冻肿瘤切片的组织荧光成像验证了 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的肿瘤特异性靶向(图 7a)。用针对 αv 和 β3 整联蛋白的抗体对肿瘤切片进行免疫荧光染色显示 αv β3 整联蛋白在肿瘤组织中的显着表达。 αv 和 β3 整联蛋白的荧光与 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的 Cy5.5 荧光合并以获得揭示共定位的免疫染色图像。肿瘤组织中的免疫荧光结果表明,Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 与 MB231 恶性乳腺癌中的αvβ3 整合素特异性结合。此外,与非靶向组相比,Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的 H&E 染色表明,所有器官组织切片均具有正常的病理形态和无组织病理学损伤反应(图 7b)。上述细胞毒性和组织学分析结果均表明,Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs对体内主要器官组织无明显毒性,其良好的生物相容性可归因于PLGA。
<图片>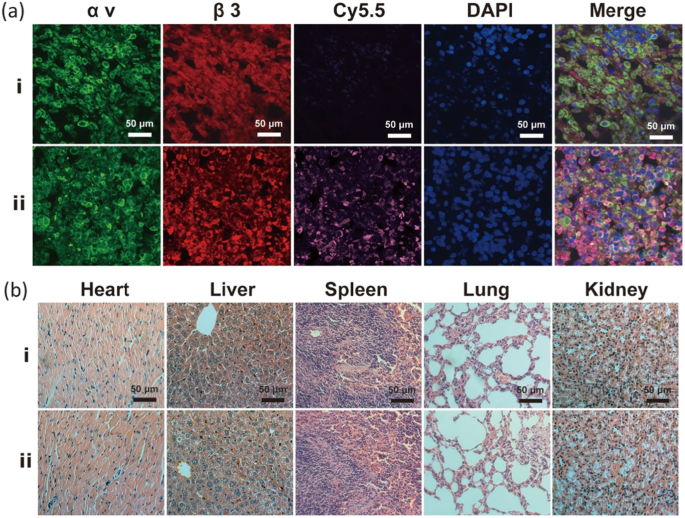
一 注射靶向和非靶向 NP 的小鼠的 MDA-MB-231 肿瘤冷冻切片的荧光成像。绿色、红色、紫色和蓝色分别代表 αv、β3、Cy5.5 和 DAPI 荧光。 b 注射靶向和非靶向NPs后小鼠H&E染色的肿瘤切片
结论
总之,上述结果证明了通过磁性靶向和在肿瘤微环境中激活的气体发生系统对乳腺癌进行 MRI 的创新和成功方法。 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs在MR/超声/荧光成像模式下表现出优异的成像性能和良好的生物相容性。我们的工作显示了改进的多模态成像在肿瘤诊断方面的巨大潜力。
材料和方法
材料
聚(乳酸-乙醇酸共聚物)(PLGA)(丙交酯:乙交酯 =75:25,Mw =20,000)、Cyanine5.5 染料和聚乙烯醇 (PVA) 购自 Sigma-Aldrich 公司(中国上海)。 RGD 肽由 GenicBio BioTech Co. Ltd.(中国上海)定制合成。 Fe3O4 纳米颗粒和碳酸钠 (Na2CO3) 购自西安瑞熙生物科技有限公司(中国河南)。二氯甲烷 (CH2Cl2) 和二甲基亚砜 (DMSO) 购自 Solarbio 公司(中国北京)。所有化学品均为分析纯。
Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD纳米颗粒的合成
首先,将 12.5 mg PLGA 和 0.25 mL 氯仿混合在一起。然后,将 5 μL Cy5.5、15 μL 油酸修饰磁性纳米粒子分散在氯仿中(OA@Fe3O4,10 mg/mL)、5 μL 碳酸钠 (Na2CO3) 和 1.5 mL 1% PVA 溶液依次加入,超声乳化2 min。然后加入12.5 mL 0.3% PVA溶液,室温搅拌3-4 h,加入12.5 mL 0.4% PVA溶液搅拌(500 rpm/min)过夜,除去残留有机溶剂。将上述溶液用 ddH2O 进行几次超滤洗涤,然后用 PB 缓冲液(pH =7.4)稀释至最终体积为 1.25 mL。接着,在上述混合溶液中加入0.25 mg EDC和1.25 mg NHS。将混合物在 25 °C 下搅拌 30 分钟,然后用超滤洗涤 3 次并重新悬浮在 PB 缓冲溶液(pH =7.4)中。接着,将1.25 mg的cRGD加入到溶液中并在4 °C下搅拌过夜。为了去除 EDC、NHS 和任何残留的 cRGD,通过超滤管过滤透明溶液。最后,Fe3O4/Na2CO3@PLGA/Cy5.5/cRGD NPs重悬于1.25 mL去离子水中,4 °C保存。
纳米粒子表征
通过 Zetasizer Nano-ZS (Malvern Instruments, UK) 测量纳米颗粒的动态直径和 zeta 电位。使用 FEI Tecnai F20 透射电子显微镜获得纳米颗粒的形态。 Cy5.5 负载由 Hitachi F-7000 荧光光谱仪记录。 FTIR 使用傅立叶变换红外光谱仪(Alpha II,Bruker,Switzerland)进行。采用振动样品磁强计(VSM,Lake Shore 7410)测定纳米颗粒和游离Fe3O4的磁滞曲线。
细胞和动物
人乳腺癌MDA-MB-231细胞由中国科学院干细胞库友情提供。细胞在 95% 空气和 5% CO2 中保持在 37°C。雌性BALB/c小鼠(4 周)购自上海斯拉卡斯实验动物有限公司,按照广西医科大学实验动物中心批准的方案进行饲养。动物实验遵循广西医科大学实验动物中心动物伦理委员会发布的《实验动物护理和使用指南》。 MDA-MB-231 乳腺癌细胞被移植到 BALB/c 小鼠的右侧(每只小鼠 2 × 106 200 μl 细胞),并在成像前生长 10-14 天(平均直径 5 mm)。
αv 整合素的细胞表达
进行细胞免疫荧光以确认 αv 整合素在 MDA-MB-231 细胞中的高表达。 A549 和 MCF-7 细胞用作对照。将细胞以 2 × 10 4 接种到 35 mm 玻璃底培养皿(MatTek,美国)上 细胞 mL −1 24 小时。孵育后,将细胞在室温下用 4% 多聚甲醛固定 20 分钟。然后,将它们与兔单克隆抗整联蛋白 αv 抗体(ab179475,Abcam)在 4 °C 下孵育过夜,并在室温下与抗兔 IgG 抗体孵育 1 小时。最后,细胞用 DAPI 染色。图像由激光共聚焦扫描显微镜(TCS SP8,Leica,Germany)获取。
为了评估纳米颗粒的靶向功效,使用共聚焦激光扫描显微镜 (CLSM) 进行了细胞摄取研究。将细胞以 2 × 10 4 接种到 35 mm 玻璃底培养皿(MatTek,美国)上 细胞 mL −1 24 小时。然后,将细胞与 RGD 靶向 NPs (30 μg mL -1 , 0.5 mL) 在 pH 7.4 下持续 2 h,非靶向 NPs 用作对照。孵育后,将细胞用4%多聚甲醛固定20 分钟,然后与αv抗体孵育。我们通过共定位验证了纳米颗粒与细胞上整合素的靶向结合。
CCK8 检测
通过细胞毒性研究评估了 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD 纳米颗粒的生物相容性。将 MDA-MB-231、A549 和 MCF-7 细胞以 5 × 10 3 接种到 96 孔板上 细胞 mL −1 24 小时。然后,将 0.1 mL 的 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NP 悬浮液以 5、10、20、40 和 80 μg/mL 的 Fe 浓度添加到每个孔中并孵育 24 h。最后加入10 μL的CCK8溶液,悬浮液再孵育1 h。结果由酶标仪(美国Thermo Scientific)在450 nm处测定。
对比增强超声成像
通过使用 Vevo 2100 (Fujifilm Visual Sonics Inc., Canada) 超声系统对纳米颗粒进行超声成像。将 RGD 靶向和非靶向 NPs 添加到琼脂糖模型中,PBS 用作对照。图像是在 B 模式和 CEUS 模式下用 7.2 和 6.8 的不同 pH 缓冲液记录的。绘制感兴趣区域,测量B超图像的平均灰度值。
对于体内超声成像,小鼠用 2% 异氟醚(河北一品制药有限公司,中国)麻醉,并用加热垫将体温保持在 37 °C。通过尾静脉注射了总共 200 μL 的 RGD 靶向 NP。对照动物皮下注射相同量的 NPs。使用 7 MHz 换能器记录超声图像,以连续获取肿瘤、肝脏和皮下区域的超声图像。将声聚焦区置于肿瘤横截面最大的中心,获得包含肿瘤及其邻近组织的视野。
磁共振成像
Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 的 MRI 检查使用 3.0 T MR(GE Healthcare,美国)和动物线圈(RF TECH LIMITED,中国)进行。在 1 mL Eppendorf 管中扫描具有 0.031、0.063、0.125、0.25、0.5 和 1 mM 不同 Fe 浓度的 NP,并使用 PBS 作为对照。使用 T2 加权 FSE 序列(切片厚度 3 mm、TR/TE 2000/74.4 ms、8 × 8 cm FOV 和 320 × 256 矩阵)对每个管进行 T2 MRI。弛豫率 (r2) 是通过逆弛豫时间与 Fe 浓度函数的线性拟合计算得出的。
对于体内 MRI,将小鼠随机分为两组(n =3) 对于接受以下任一者的 MR 扫描 (1) 在皮下肌肉和肿瘤组织内局部注射 Na2CO3/Fe3O4@PLGA/Cy5.5/RGD NPs 或 (2) 尾静脉注射 Na2CO3/Fe3O4@PLGA/Cy5.5 /RGD NP。在注射纳米颗粒之前拍摄小鼠的基线图像。对于第一组,将等量的NPs注射到皮下组织和肿瘤组织中,每30 min进行一次MRI扫描,记录组织的信号转变。第二组在轴位和冠状位进行肿瘤成像,MR参数与体外成像相同。测量感兴趣区域(ROI)的信号强度(SI),并与注射前后不同时间的组织信号进行比较。
肿瘤荧光成像
体内荧光成像采用体内荧光成像系统(FX PRO,Bruker,Switzerland)进行扫描,将小鼠随机分为两组(n =3):(1) RGD-targeted NPs 和 (2) non-targeted NPs。在注射后的 4 小时期间,每 30 分钟捕获一次图像。随后,对重要器官和肿瘤进行采集和成像,并观察荧光在身体各器官中的分布情况。使用分子成像软件(Bruker,Switzerland)进行荧光强度的定量分析。然后对这些重要器官进行 H&E 染色以评估组织毒性。冷冻肿瘤切片也用αv integrin和β3 integrin抗体进行荧光免疫染色。
数据和材料的可用性
本手稿中的结论是基于本文提供和展示的所有数据。
缩写
- Cy5.5:
-
Sulfo-Cyanine5.5 NHS酯
- DAPI:
-
4',6-二脒基-2-苯基吲哚
- EDC:
-
1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐
- FSE:
-
快速自旋回波
- MR:
-
磁共振
- NHS:
-
N-羟基琥珀酰亚胺
- PB:
-
磷酸盐缓冲液
- PBS:
-
磷酸盐缓冲盐水
- PEG:
-
聚乙二醇
- PVA:
-
聚乙烯醇
- RGD:
-
精氨酸-甘氨酸-天冬氨酸
- TE:
-
回声时间
- TR:
-
重复时间
纳米材料
- 用于化学传感器的金纳米粒子
- 用于灵敏快速检测卵巢癌细胞的柔性石墨烯生物传感器的演示
- 用于癌症治疗的纳米粒子:当前的进展和挑战
- 131I 追踪的 PLGA-脂质纳米颗粒作为靶向化疗治疗黑色素瘤的药物递送载体
- 以叶酸受体为靶点的生物类黄酮染料木素负载壳聚糖纳米颗粒可增强对宫颈癌的抗癌作用
- 用于体内 CT 成像和肾脏清除特性的新型生物相容性 Au Nanostars@PEG 纳米颗粒
- 用于光热疗法和光声成像的聚吡咯涂层铁铂纳米粒子的合成和体外性能
- 用于细胞成像的近红外发射 Cr3+/Eu3+ 共掺杂锌镓锗酸盐持久性发光纳米颗粒
- 用 Au 纳米粒子定制的二氧化硅硅藻壳可以对用于生物、安全和环境应用的分子进行灵敏分析
- 适体修饰的磁性纳米增敏剂,用于表达 HER2 的癌症的体内 MR 成像
- 131I 标记的抗 VEGFR2 靶向介孔二氧化硅纳米颗粒在甲状腺未分化癌中的抗肿瘤作用
- 用于生物医学、药物输送和成像应用的磁性功能化纳米粒子


