生物相容性纳米颗粒作为增强顺铂-四氢嘧啶组合抗肿瘤功效的平台
摘要
联合治疗已成为临床肿瘤治疗的标准策略。我们已经证明,Tetradrine (Tet) 和顺铂 (CDDP) 的组合具有显着的协同抗癌活性,但不可避免的副作用限制了它们的治疗浓度。考虑到两种药物的不同理化和药代动力学特性,我们通过改进的双乳法将它们一起装入纳米载体中。纳米颗粒(NPs)由聚(乙二醇)-聚己内酯(PEG-PCL)和聚己内酯(HO-PCL)的混合物制备而成,因此CDDP和Tet可以同时定位到纳米颗粒中,干扰小,稳定性高.来自荧光显微镜的图像揭示了 NPs 提供的亲水性和疏水性试剂的细胞摄取。对不同肿瘤细胞系和肿瘤组织的体外研究显示肿瘤抑制率和细胞凋亡率增加。至于体内研究,在NPs组中观察到优异的抗肿瘤功效和减少的副作用。此外, 18 FDG-PET/CT 成像表明 NPs 更显着地降低了肿瘤的代谢活动。我们的研究结果表明,PEG-PCL 嵌段共聚纳米颗粒可能是一种有前景的联合化疗载体,疗效可靠,副作用小。
介绍
随着肿瘤综合治疗的发展,铂类化合物在多种癌症的治疗中发挥着重要作用,其中顺铂(CDDP)在临床上得到广泛应用[1, 2]。目前,CDDP联合肿瘤免疫治疗仍具有重要意义,对非小细胞肺癌(NSCLC)等恶性肿瘤显示出良好的疗效[3]。然而,这些化学治疗剂总是以牺牲不良毒性为代价来实现抗肿瘤活性[4],因此一直在不断探索能够降低毒性和增强化疗疗效的治疗剂[5, 6]。粉防己碱(Tet)是双苄基异喹啉生物碱的一员[7],在化疗致敏方面表现出令人满意的效果。我们之前的工作表明,Tet 和 CDDP 的组合确实通过抑制化疗药物相关基因的表达而具有显着的协同抗癌活性,包括切除修复交叉互补组 1 (ERCC1)、胸苷酸合成酶 (TS)、β-微管蛋白 III 等 [8]。然而,Tet 的临床应用存在水溶性差和口服生物利用度低的问题[7]。此外,亲水性 CDDP 最容易分布在细胞外基质 (ECM) 中,而疏水性 Tet 穿透脂质膜可以通过细胞运输,因此两种药物不能真正协同工作。因此,寻找一种能够同时有效地递送两种药物,提高抗肿瘤效果,减少副作用的方法至关重要。
纳米技术领域的最新进展管理了癌症诊断和治疗的新方法 [9, 10]。由两亲性共聚物,尤其是聚乙二醇 (PEG) 构建的纳米颗粒 (NP) 以其减少血清蛋白粘附和阻止网状内皮系统 (RES) 摄取的能力而闻名 [11]。如果用于携带疏水性药物,纳米载体巧妙地增加了溶解度,延长并增加了药物在血液循环和肿瘤中的停留时间 [12]。随着共聚纳米颗粒的临床应用,纳米颗粒的生物相容性越来越受到关注。例如,最近的研究结果表明,一些注射的二氧化钛、二氧化硅和金纳米粒子会加速动物模型中癌细胞的内渗和外渗 [13]。由具有良好生物相容性和安全性的纳米材料制备的纳米颗粒,尤其是获得FDA批准的纳米颗粒,是较好的药物载体候选。
初步,我们已经成功地使用聚乙二醇-聚(己内酯)(PCL-PEG)[16] 构建了加载 CDDP 的 NPs [14, 15] 和加载 Tet 的 NPs,其体内抗肿瘤作用均已得到证实。在这项研究中,我们使用 PEG-PCL 来共同递送 CDDP 和 Tet。 PEG 具有近中性电荷,形成纳米颗粒的亲水壳,隐藏抗原表位并防止免疫反应 [14]。来自荧光显微镜的图像表明,细胞可以吸收 NPs 提供的亲水性和疏水性试剂。不仅针对不同肿瘤细胞系,而且针对肿瘤组织的体外研究结果表明,CDDP-Tet NPs 比游离药物更有效地抑制肿瘤生长。在体内研究时,观察到 NPs 组的抗肿瘤功效增加,副作用减少。此外, 18 FDG-PET/CT成像显示NPs组肿瘤的代谢率最差,表明CDDP-Tet NPs具有延缓肿瘤生长的能力。
方法
材料
试剂和细胞
CDDP(分子式 PtCl2(NH3)2)购自山东博源制药有限公司(中国济南)[15]。粉防己碱(分子式 C38H42N2O6)是从江西怡博医药开发公司(中国江西)获得,纯度为> 98%的粉末[16]。甲氧基聚乙二醇 [MePEG;重均分子量(Mw =4 kDa;中国南京威尔化学有限公司)通过与甲苯共沸蒸馏脱水,然后在 50°C 下真空干燥 12 小时,然后使用。ε-己内酯(ε-CL;Aldrich ,美国)通过在室温下用 CaH2 干燥然后在减压下蒸馏来纯化。聚乙烯醇(PVA;聚合度 =500,醇化度 =88%;上海东仓国际贸易有限公司,中国)和辛酸亚锡(分子式 SnCl2) (Sigma) 原样使用。使用 RPMI 1640 培养基(Gibco,美国)、小牛血清(兰州民海生物工程公司,中国)和二甲基噻唑-2,5-二苯基溴化四唑(MTT;Amersco,美国)原样。
人分化良好的胃癌细胞系 MKN28、人结直肠腺癌细胞系 LoVo、人宫颈癌细胞系 Hela 和鼠肝癌细胞系 H22 购自上海细胞生物学研究所(中国上海)。所有细胞系在 RPMI 1640 培养基中增殖,在 37°C 的水饱和气氛中,补充有 10% 牛血清、青霉素 (100 U/mL)-链霉素 (100 g/mL)、丙酮酸、谷氨酰胺和胰岛素5% 二氧化碳。
共聚物的合成
正如我们之前描述的 [16, 17],mPEG-PCL 和 HO-PCL 共聚物是通过开环共聚反应合成的。简而言之,将预定量的 ε-CL 添加到含有 PEG 和少量辛酸亚锡 (0.1% wt/wt) 的聚合管中。然后将管连接到真空系统,密封,并在 130°C 的油浴中放置 48 小时。为了合成 HO-PCL 共聚物,在不干燥的情况下将预定量的 ε-CL 和辛酸亚锡加入聚合管中。聚合完成后,将粗共聚物用氯仿溶解并沉淀到过量的冷甲醇中以除去未反应的单体和低聚物。将沉淀物过滤并用水洗涤数次,然后彻底减压干燥。
载有 CDDP-Tet 的纳米颗粒的制备
通过双乳液 (DE) 方法制备预定量的 CDDP 和负载 Tet 的纳米粒子 [14, 18]。 CDDP 和 Tet 用含有 5 mg mPEG-PCL 和 15 mg HO-PCL 的 1 mL 二氯甲烷 (DCM) 溶液乳化,通过在冰浴中超声 15 秒(15 W)(溶液 W1)。然后,加入 4 mL 3% (w/v) PVA 溶液 W2 并超声处理 30 秒以制备 W1/O/W2 乳液。将双乳液稀释到 50 mL 的 0.3% (w/v) PVA 水溶液中,并在真空下蒸发 DCM。收集、洗涤和冷冻干燥获得的纳米颗粒(图 1)。
<图片>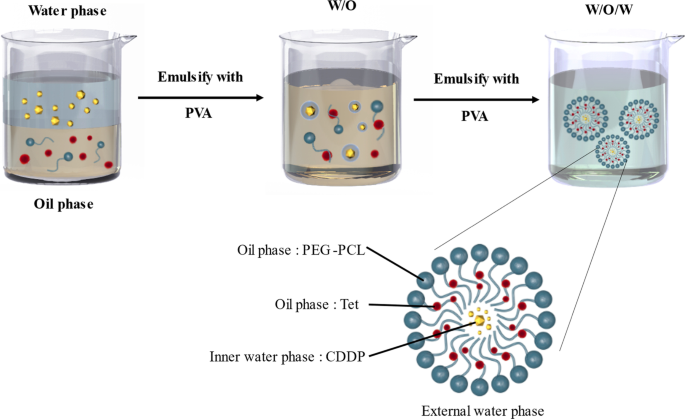
CDDP-Tet NPs制备方案
载药内容和封装效率
为了确定载药量,将冷冻干燥的载有 CDDP-Tet 的 NP 粉末溶解在二甲基甲酰胺 (DMF) 中,并将 30 L 该溶液与 30 L 2 mmol/L HCl 混合,然后加入 2.94 mL 2 mmol/L HCl 中的 0.2 mmol/L SnCl2 溶液。 1 小时后使用 Shimadzu UV-1205 分光光度计(日本京都)参照校准曲线测量 403 nm 处的吸光度。然后可以计算 NPs 中药物的总量。载药量和包封率分别由方程获得。 (1)和(2):
$${\text{载药量}}\, (\% ) =\frac{{{\text{纳米颗粒中药物的重量}}}}{{{\text{纳米颗粒的重量}}}} \times 100\,(\% )$$ (1) $${\text{封装效率}}\,(\% ) =\frac{{{\text{纳米颗粒中药物的重量}}}}{ {{\text{喂食药物的重量}}}} \times 100\,(\% )$$ (2)纳米颗粒的体外细胞毒性和生物相容性研究
细胞摄取研究
在我们之前的工作[15]的基础上,将LoVo细胞放置在6孔板的盖子上,大约5 × 10 5 细胞每个孔并孵育 24 小时(37°C,5% CO2)。将含有罗丹明 B (21 μg/mL) 的 NP 添加到孔中。孵育 2 小时后,用 4°C 和 37°C 的 PBS 分别洗涤肉酱 3-4 次。将盖玻片上的 LoVo 细胞置于荧光显微镜下。
细胞毒性分析
药物的体外细胞毒性通过标准 MTT 分析使用 MKN28 和 H22 细胞系确定。简而言之,在测定前 24 小时,将细胞以每孔 5000 个细胞的密度接种在 96 孔板中。然后将细胞暴露于一系列剂量的游离 CDDP、游离 Tet、游离 CDDP 加 Tet 和加载 CDDP-Tet 的纳米颗粒。孵育后,每孔加入 20 μL 5 mg/mL MTT 溶液,将板孵育 4 小时,使活细胞将黄色 MTT 转化为深蓝色甲臜晶体,溶解在 200 μL 的二甲基亚砜(DMSO)。分别使用 490 和 630 nm 的测试和参考波长通过 ELISA 读数器(ELX800 Biotek,美国)测量每个孔的光密度 (OD)。细胞活力由下式确定:
$${\text{细胞活力}}\,(\% ) =\frac{{{\text{OD(测试井)}}}}{{{\text{OD(参考井)}}}} \乘以 100\,(\% )$$ (3)空白纳米颗粒的体外相容性也通过使用 MKN28 和 H22 细胞系的 MTT 测定来确定。通过在至少三个独立场合重复实验并每次重复三次测试,证实了从 MTT 测定中获得的所有结果。
细胞凋亡检测
采用 Annexin V-FITC Kit (Bender MedSystem, USA) 检测细胞凋亡率的变化。 MKN28 细胞在 6 cm 培养皿中培养 24 小时。分别用 1 μg/mL 游离 CDDP、1 μg/mL CDDP 负载 NP 和 200 μg/mL 空白 NP 替换培养基。对照组更换为不含药物的培养基。培养 48 小时后加入酶。然后收集细胞,用 PBS 洗涤 2 次,并重悬于 100 μL 缓冲液中。依次加入 Annexin V 5 μL 和 PI 1 μL,混合,室温静置 15 分钟,避光。加入400 mL缓冲液,进行FCM(BD FACS CantoTM,USA)过程进行细胞凋亡率分析。
组织培养药物反应分析 (HDRA)
HDRA 是根据我们之前的研究进行的 [14, 19]。简而言之,雄性ICR小鼠在腋窝处皮下注射4-6 × 10 6 盐水中的 H22 细胞。当肿瘤达到400-600 mm 3 按体积计算,颈椎脱臼处死小鼠,取新鲜标本,用生理盐水冲洗两次,浸入汉克氏液中,分成约 15 毫克的块。将组织样品置于 24 孔板中,将 1 cm 尺寸的方形明胶海绵浸入 RPMI 1640 培养基中,该培养基补充有 20% 胎牛血清和含有游离 CDDP 或 CDDP-的硫酸阿米卡星 (100 IU/mL)。加载两种不同浓度的 NP。四个肿瘤样本在没有任何药物的情况下孵育作为对照。然后将组织在 37°C 5% CO2 下培养 7 天。添加 I 型胶原酶(100 L,0.6 mg/mL)和 MTT(100 L,5 mg/mL)在 100 mg/mL 琥珀酸钠中的混合溶液。再孵育 24 小时后,MTT 甲臜用 1 mL DMSO 提取,每孔中的 100 L 溶液转移到 96 孔微孔板的孔中。使用 ELISA 读数器分别在 490 和 630 nm 的测试和参考波长下测量微孔板中每个孔的 OD。组织活力按以下公式(4)计算:
$${\text{组织活力}}\,(\% ) =\frac{{{\text{OD(测试)}}/{\text{重量(测试)/mg}}}}{{{\ text{OD(对照)}}/{\text{重量(对照)/mg}}}} \times 100\,(\% )$$ (4)体内抗肿瘤功效
肿瘤体积测量
将体重在 18 至 20 克之间的雄性 ICR 小鼠植入鼠肝癌细胞系 H22,并用于鉴定加载 CDDP-Tet 的 NP 的相对功效。在无特定病原体 (SPF) 的情况下饲养,小鼠按照鼓楼医院动物护理委员会批准的准则进行操作。 0.2 mL 含有 4–6 × 10 6 的细胞悬液 H22 细胞被皮下注射到小鼠的左腋窝。小鼠分为6组:对照组(生理盐水)、空白NPs组、游离CDDP(3 mg/kg)组、游离CDDP加Tet(CDDP 3 mg/kg + Tet 7.2 mg/kg)组和CDDP-负载 Tet 的 NP(CDDP 3 mg/kg + Tet 7.2 mg/kg)组。每组由6只小鼠组成。在植入 7-8 天后开始治疗,这一天被指定为“第 0 天”。每只动物在治疗时称重,以便调整剂量以达到报告的 mg/kg 剂量。整个实验过程中每隔一天对动物称重一次。
免疫荧光检测
在治疗后第21天,选择对照组小鼠和接受游离CDDP加Tet和CDDP-Tet NPs的小鼠肿瘤组织进行组织学观察。将肿瘤解剖并固定在 10% 中性缓冲福尔马林中,常规加工成石蜡,切片厚度为 5 毫米。在样品用(40,6-二脒基-2-苯基吲哚)(DAPI,蓝色)和末端脱氧核苷酸转移酶 dUTP 缺口末端标记(TUNEL,绿色)染色后,在蔡司 LSM510 Meta 共聚焦显微镜下观察组织切片 [20] .
18 FDG-PET/CT 成像
然后在治疗后第 6 天对游离 CDDP 加 Tet 组和 CDDP-Tet 负载 NPs 组的小鼠进行 PET/CT 成像。注射示踪剂前禁食 4 小时。 18 的 14.8 MBq (400 lCi) F-FDG 通过尾静脉注射作为放射性示踪剂。图像是用组合式 PET/CT 扫描仪(Jemini JXL,飞利浦,美国)生成的。 18 给药后 45 分钟,小鼠获得高分辨率 PET 图像和相同的 CT 视野 F-FDG。根据 CT 数据对 PET 图像进行衰减和散射校正。图像融合由自动图像融合系统执行,使用供应商提供的软件。计算标准摄取值 (SUV) 获得肿瘤中的最大 FDG 摄取值,并对体重和注射活性进行校正。
统计方法
使用 Student's t 对数据进行统计分析 测试。数据以平均值 ± SD列出,P的值 <0.05被认为具有统计学显着差异。
结果
共聚物合成与表征
根据我们之前的研究,我们用 PEG-PCL 和 HO-PCL 合成了 NPs(最佳比例为 1:3)[14]。最佳 PEG-PCL 共聚纳米颗粒的直径、多分散性、数均分子量 (Mn) 和重均分子量 (Mw) 显示在附加文件 1:表 S1 中。当加载 CDDP 和 Tet 时,还测量了载药量和包封效率(附加文件 1:表 S2),这与加载 CDDP 的 PEG-PCL 共聚纳米颗粒相似。然而,Tet的载药量和载药效率低于载有Tet的PEG-PCL共聚纳米粒,这可能与HO-PCL组分有关。
通过动态光散射 (DLS),负载 CDDP-Tet 的 PEG-PCL 共聚 NP 的直径为 359.1 ± 5.3 nm,多分散性约为 0.231。当通过 TEM 和 AFM 观察(附加文件 1:图 S1a 和 S1b)时,NP 呈现规则的球形和相似的尺寸,这与来自 DLS 的数据一致。此外,纳米颗粒中分散有小液滴,证实纳米颗粒确实是双乳液结构。
CDDP-Tet-Loaded NPs 的细胞摄取
负载荧光染料的粒子已被用作探索细胞摄取的常用方法,实现了视觉和实时检测。我们已经证明载有染料的 NPs 可以通过内吞作用进入细胞。在本研究中,罗丹明-B 是亲水性的,可以在 PI 荧光通道中检测到,用于模拟 CDDP。作为Tet的模拟,香豆素6是疏水性的,其信号可以在FITC荧光通道中接收。与负载香豆素-6 和罗丹明-B 的 NP 共孵育 2 小时后,通过荧光显微镜和光学透镜 (200 ×) 检测到 LoVo 细胞。如图 2 所示,可以在 PI 荧光通道、FITC 荧光通道以及 PI/FITC 双荧光通道中检测到荧光信号。结果证实NPs可以同时携带香豆素6和罗丹明B到肿瘤细胞,据此推测CDDP和Tet可以同时加载到NPs中并被肿瘤细胞吸收。
<图片>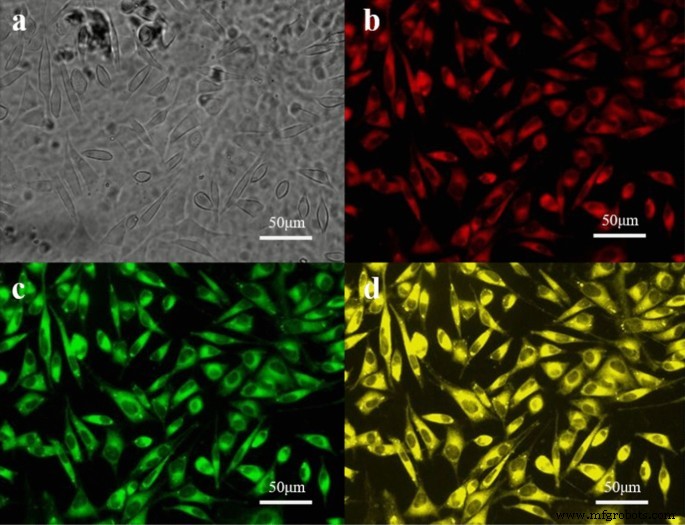
LoVo 细胞在用加载有罗丹明 B 和香豆素-6(200 × ;条形:50 um)的 NP 染色 2 小时后的照片。 一 光镜下细胞形态,b 荧光显微镜下细胞形态(PI荧光通道),c 荧光显微镜下细胞形态(FITC荧光通道),d 荧光显微镜下细胞形态(PI/FITC双荧光通道)
纳米颗粒的体外细胞毒性
在胃细胞系 MKN28 中比较了游离 CDDP、游离 Tet、游离 CDDP 加 Tet 和加载 CDDP-Tet 的 NPs 的细胞毒性。 Tet的浓度是CDDP浓度的2.4倍。如图 3 所示,加载 CDDP-Tet 的 NP 的细胞毒性在四组中最强。随着浓度的增加,游离Tet与NPs组和其他三个游离药物组的细胞毒性差异变得明显。在人宫颈癌细胞 Hela 和肝细胞癌细胞 H22 中观察到类似的结果(附加文件 1:图 S2a、S2b)。
<图片>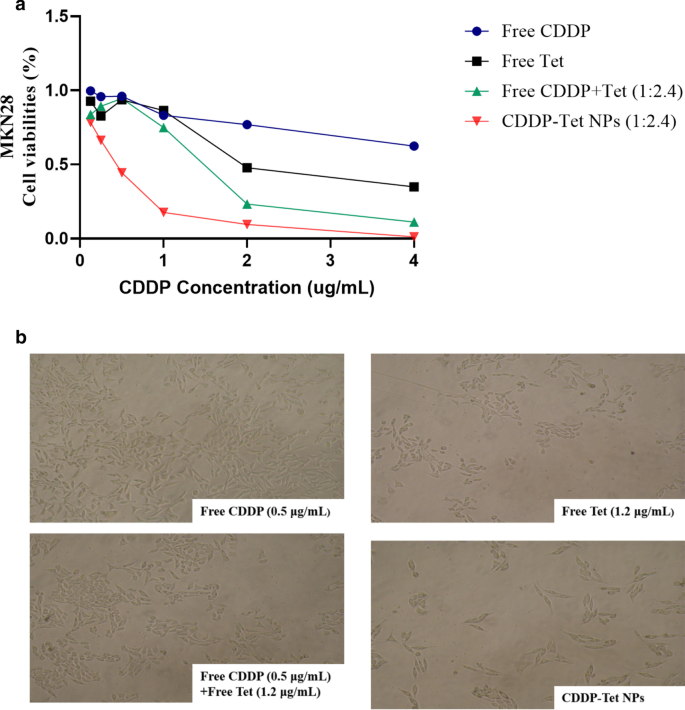
纳米颗粒的体外细胞毒性。 一 MKN28 与药物共培养 48 小时后的细胞活力。 Tet的浓度是CDDP浓度的2.4倍。 b MKN28细胞与药物共培养48 h后光镜(200 ×)照片
在我们之前的工作中已经进行了空白 NPs 的毒性研究。以往研究中空白NPs对肿瘤细胞系的毒性很小,表明空白NPs具有良好的生物相容性[14, 16]。
加载 CDDP-Tet 的 NP 的体外细胞凋亡分析
我们测量了 1 μg/mL 游离 CDDP、2.4 μg/mL 游离 Tet、游离 CDDP 加 Tet(1 μg/mL + 2.4 μg/mL)和加载 CDDP-Tet 的 NP(1 μg/mL + 2.4 μg)的影响/mL) 共培养 48 小时后 MKN28 细胞的凋亡率。细胞凋亡率计算为 Q2 + Q4(如图 4 所示)。游离 CDDP 加 Tet、游离 CDDP 和游离 Tet 组之间的细胞凋亡率变化相似(图 4a-c)。然而,负载CDDP-Tet的NPs诱导的MKN28细胞凋亡率明显高于其他三组(图4d)。
<图片>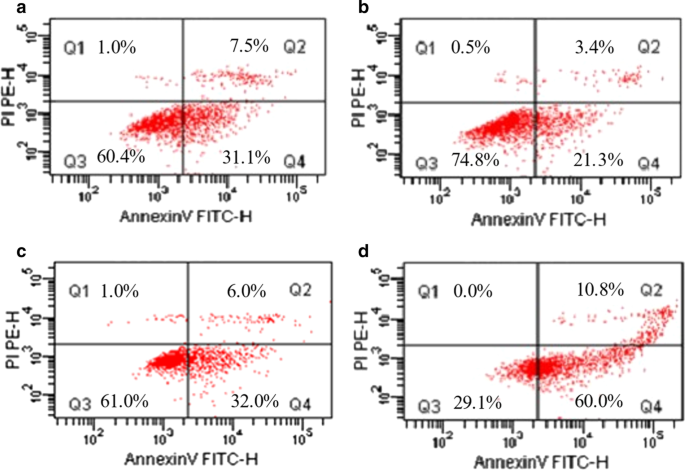
流式细胞术体外细胞凋亡分析a 免费 CDDP,b 免费的春节,c 免费 CDDP + Tet 和 d CDDP-Tet NPs
组织培养药物反应分析 (HDRA)
为了更全面地评估 NPs 的抗肿瘤效果,我们使用 HDRA 评估了游离 CDDP、游离 CDDP 加 Tet 和加载 CDDP-Tet 的 NPs 对 H22 细胞系的抗肿瘤作用。作为一种预测化疗敏感性的临床方法,HDRA比细胞学实验更真实地模拟了肿瘤组织的实际情况[19],其结果受药物渗透、细胞外pH值、细胞间质等肿瘤组织微环境和微观结构的影响。流体压力等
Tet 的浓度是 CDDP 浓度的 2.4 倍。如图 5 所示,在最低浓度下,游离 CDDP 和 Tet 组的抗肿瘤效果优于 CDDP,但随着药物浓度的增加,效果相似。与细胞凋亡分析一致,CDDP-Tet负载的NPs在所有测试浓度的三组中均具有明显更好的抗肿瘤作用。
<图片>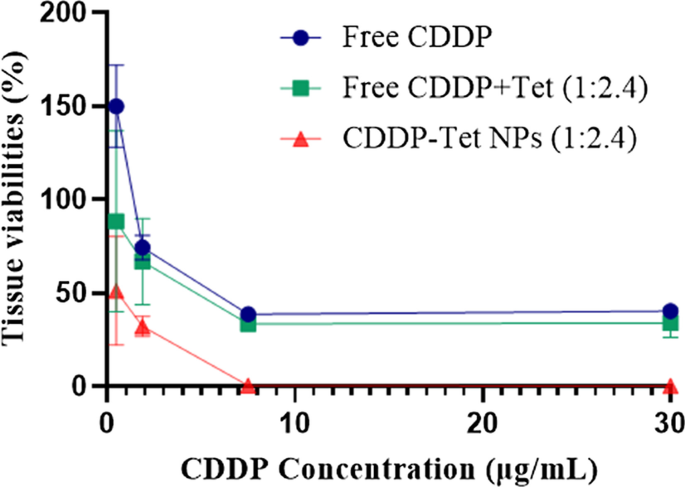
组织培养药物反应试验
体内抗肿瘤功效分析
疗效和副作用评估
用 3 mg/kg 游离 CDDP、游离 CDDP 和 Tet(CDDP 3 mg/kg + Tet 7.2 mg/kg)、载有 CDDP-Tet 的 NP(CDDP 3 mg/kg)处理由 H22 细胞系移植形成的鼠模型+ Tet 7.2 mg/kg),分别。药物治疗后12天获得肿瘤。每 2 天检测一次肿瘤大小,以确定最佳的药物递送含量。如肿瘤生长曲线所示(图6),对照组和空白纳米粒组的肿瘤生长趋势相似,但其他三组药物递送均存在显着的肿瘤抑制作用。与游离 CDDP 组相比,游离 CDDP 加 Tet 组在前 6 天表现出更好的抗肿瘤效果。但6天后,两组抑瘤率差异开始缩小,10天后,游离CDDP加Tet的抗肿瘤效果更差。
<图片>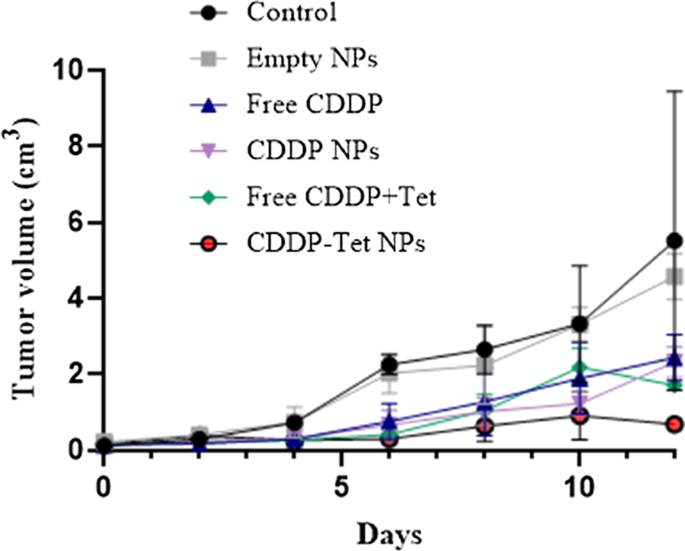
在不同治疗下治疗期间 ICR 小鼠中已建立的 H22 异种移植物的肿瘤体积。如图所示,在第 0 天用不同策略处理小鼠:3 mg/kg 游离 CDDP、游离 CDDP 和 Tet(CDDP 3 mg/kg + Tet 7.2 mg/kg)和加载 CDDP-Tet 的 NP( CDDP 3 mg/kg + Tet 7.2 mg/kg)。平均值 ± SD (n =6) 每组测量
在前 6 天,游离 CDDP 加 Tet 和 CDDP Tet 负载 NPs 组的抗肿瘤作用相似。因此,自治疗后第 6 天起,接受载有 CDDP-Tet 的 NPs 的小鼠表现出更好的抗肿瘤功效。附加文件 1:图 S3a 显示了每组不同的肿瘤大小。 CDDP-Tet负载NPs组的肿瘤体积最小,可以看作是显着抗肿瘤作用的直接反映。除肿瘤抑制能力外,与游离CDDP或游离CDDP加Tet组相比,位于肿瘤表面的血管较少)。同样,如附加文件1:图S3b所示,相对于对照组和游离CDDP加Tet组,NPs组的血管密度最低。
为进一步研究体内肿瘤组织中凋亡细胞的比例,采用TUNEL法检测凋亡细胞。如图 7 所示,肿瘤中的凋亡细胞可以被绿色荧光染色以指示细胞凋亡。合并后的图像显示对照组和游离 CDDP 加 Tet 组中的绿色荧光区域较少,表明存在较少的凋亡细胞。此外,在用CDDP-Tet NPs处理的组中观察到大量绿色荧光区域,表明大量凋亡细胞。结果证实CDDP-Tet NPs可促进体内肿瘤细胞凋亡。
<图片>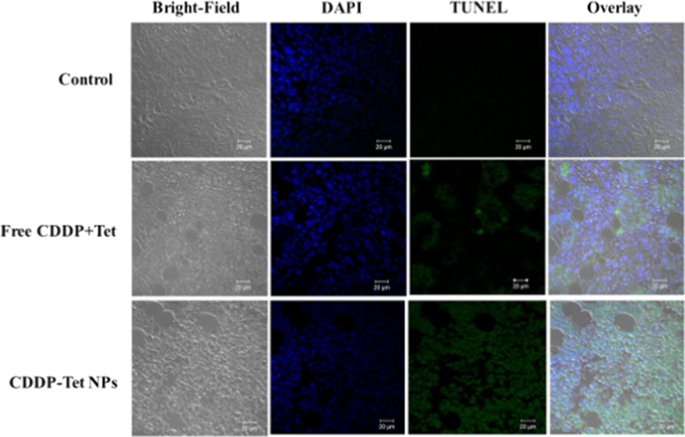
TUNEL法检测凋亡细胞(绿色),核染色DAPI共染色(蓝色)
除了比游离 CDDP 和游离 CDDP 加 Tet 组具有更好的抗肿瘤功效外,加载 CDDP-Tet 的 NP 还显示出较少的副作用。如图 8a 所示,与对照组相比,游离 CDDP 和游离 CDDP 加 Tet 引起显着的体重减轻,表明直接给药的毒性。空白NPs组的体重变化曲线与对照组相似,表明空白NPs的毒性可以忽略不计。在前 6 天,由加载 CDDP-Tet 的 NPs 和对照组引起的体重减轻相当。从第6天到第12天,NPs组小鼠体重水平略低于对照组,但高于游离CDDP或游离CDDP加Tet组。值得注意的是,游离CDDP加Tet组在前4天有明显的体重减轻和小鼠食欲下降,表明药物的吸收对全身有害。相比之下,CDDP-Tet负载的NPs可以在组织中缓慢释放并保持浓度稳定;因此,与直接给药相比,副作用明显降低。然后,还通过肝活检评估了治疗的副作用(图 8b)。与对照组相比,双药裸药组肝细胞边界模糊,部分肝细胞有气球样改变,细胞体缩小,核固缩,嗜酸性粒细胞增多(黄色箭头),而纳米粒子组。干细胞结构正常,细胞间隙清晰,无明显病理改变。这些结果表明NPs的传递几乎没有造成损害。
<图片>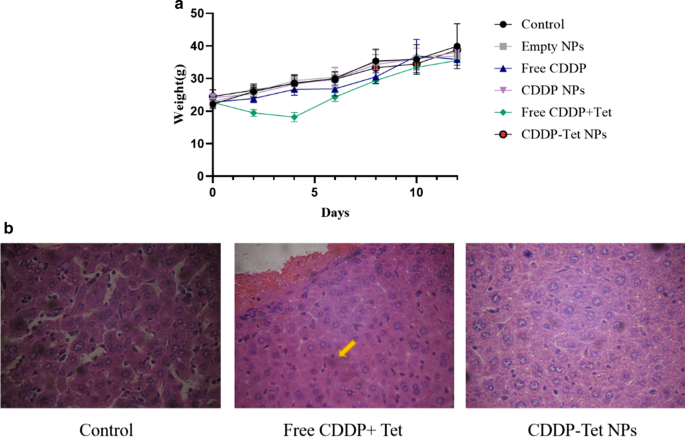
副作用评估a 在不同治疗下治疗期间 ICR 小鼠中已建立的 H22 异种移植物的体重。 b 肝标本HE染色光镜观察(400 ×)
PET–CT
为了更好地比较各组的体内治疗效果,在治疗后第6天对小鼠进行CT、PET/CT扫描。 CT和PET扫描的融合图像如图9所示。PET/CT是通过 18 反映代谢变化的有效方法 FDG摄取检测[21]。 CT 扫描显示(图 9),游离 CDDP 加 Tet 组和加载 CDDP-Tet 的 NPs 组的肿瘤体积相当(图 9a),但游离 CDDP 加 Tet 组的肿瘤代谢率显着高于NPs 组(图 9b)。 The decreased intensity at the tumor site of the murine received CDDP-Tet-loaded NPs symbolized poor metabolism rate of the tumor, and thereby indicating the capability of NPs to retard tumor growth.
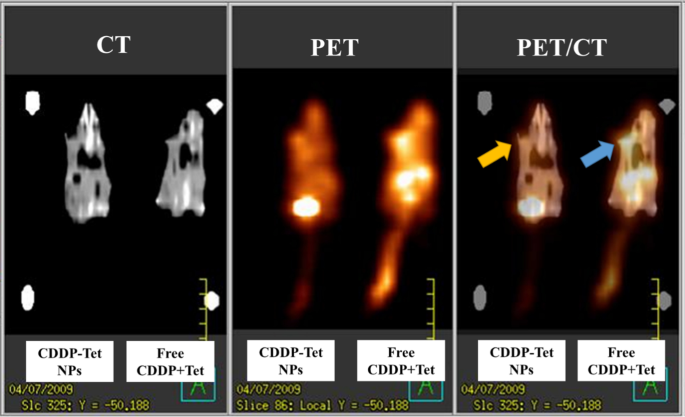
Male ICR mice bearing a subcutaneous H22 tumor at the left axillary (arrows). CT, PET and fused PET/CT images are arranged in the figure from left to right. Tumor metabolic rate in free CDDP plus Tet group (blue arrow) was significantly higher than NPs group (yellow arrow)
讨论
Considering the heterogeneity and complexity of tumor, combination therapy has become a standard strategy in the clinical treatment of tumor [22]. Nevertheless, simple combination of two individual therapeutics can't necessarily reach anticipated effect because of the different physicochemical and pharmacokinetic properties of the two drugs [23]. To deliver different drugs to tumor cells in a synergistic ratio, a combination therapy vehicle has been designed in this study. CDDP is hydrophilic while Tet is hydrophobic, which cause problems for the loading method. In this study, we used the amphiphilic copolymer with PCL as the hydrophobic core and PEG as the hydrophilic corona [14]. By the improved double emulsion method, Tet located in the oil layer and CDDP located in the water layer, the unique structure imparts the NPs with the capacity to simultaneous encapsulation of Tet and CDDP to form NPs. CDDP and Tet are located in different layers of NPs, resulting in low interfering effect and high stability [24].
The combination therapy vehicle loaded with CDDP and Tet can enhance the efficacy of CDDP-Tet combination. Not only in the cellular experiments, CDDP-Tet NPs also significantly inhibit tumor tissue viabilities in the HDRA assays, validating the anti-tumor effect of the NPs in the model which take into account of tumor microenvironment [19]. As to in vivo study, antitumor efficacy was observed in tumor volume change, which demonstrated that CDDP-Tet NPs effectively suppressed tumor growth with lower proliferation level. 18 FDG-PET/CT imaging revealed that the glucose metabolism of the tumors in the CDDP-Tet group was inhibited more prominently and early by inducing higher apoptosis level of tumors, which was confirmed in the immunofluorescence assays [21]. Compared with free CDDP plus Tet, CDDP-Tet NPs are faster and safer to take effect, which can be explained by the three mechanisms as follows.
Firstly, as a lipid-soluble drug, Tet can hardly distribute in the ECM and therefore rarely diffuse around tumor cells [9]. Located in the oil phase of NPs, Tet is endowed with better solubility and bioavailability, reaching the tumor sites in the same synergistic ratio as CDDP. Furthermore, CDDP, which used to have systemic side effect, once carried by the nanoparticle, can easily reach the interstitium of tumor tissues from leaky tumor blood vessels and be held within the tumor on account of pressure made by destitute lymphatic drainage [25]. The more CDDP tumor tissues hold, the less damage will be done to normal organs. As a result of passive targeting strategies, CDDP-Tet NPs are much safer than free CDDP plus Tet, which can be observed in the murine body weight changes and liver biopsies.
Drug resistance is regarded as one of the greatest challenges in cancer treatment, not only because of genetic changes at the level of a single cell, but also due to tumor tissues and microenvironment [26]. On one hand, Tet is alkaline, so it will be protonated in the acidic tumor microenvironment and thus can’t cross the electronegative tumor cytomembranes, which is called pH-induced physiological drug resistance [27]. On the other hand, large distances between blood vessels in solid tumors and high interstitial fluid pressure contribute to limited distribution of CDDP and Tet [28]. Carried by the nanovehicle, Tet can enter tumor cells via endocytosis without influence of tumor microenvironment, overcoming the pH-induced physiological drug resistance. The small size of nanocarriers allows them to enter tumor vasculature and preferentially accumulating at the tumor site in vivo [29, 30].
In summary, this study represents an example of delivering a chemotherapeutic drug along with a chemosensitizer simultaneously. Carried by the NPs, both drugs are targeted to tumor site passively, reducing systemic toxicity. Besides, NPs offer a solution to physiological drug resistance by helping the chemosensitizer enter tumor cells more and faster, which play an important role in improving the efficacy of tumor chemotherapy. Therefore, we believed that this PEG–PCL block copolymeric NPs could be a promising carrier for combined chemotherapy.
Conclusions
Based on our previous studies [8, 14, 16], this paper investigated the application of PEG–PCL/HO-PCL NPs for delivery of the combination of two drugs with different physicochemical properties. For in vitro studies, NPs exhibited superior antitumor effect with great biocompatibility. Enhanced antitumor efficacy was observed in tumor volume change and 18 FDG-PET/CT Imaging as to in vivo study in murine model. The mice in NPs group also exhibited reduced side effects. Additionally, the apoptosis rate of tumor cells was promoted by NPs in both in vitro and in vivo studies. In summary, this block copolymeric NPs could be a promising carrier for the delivery of Cisplatin–Tetradrine combinations and other combinations, with enhanced antitumor effect and reduced toxicity, for the treatment of cancer.
数据和材料的可用性
The datasets used and/or analysed during the current study are available from the corresponding author on reasonable request.
缩写
- Tet:
-
Tetradrine
- CDDP:
-
Cisplatin
- NP:
-
Nanoparticle
- PEG–PCL:
-
Poly(ethyleneglycol)–polycaprolactone
- HO-PCL:
-
Polycarprolactone
- ECM:
-
细胞外基质
- PEG:
-
聚乙二醇
- RES:
-
Reticuloendothelial system
- DMF:
-
二甲基甲酰胺
- SPF:
-
Specific pathogen-free
- 锰:
-
数均分子量
- 分子量:
-
重均分子量
- DLS:
-
动态光散射
纳米材料
- IBM 科学家率先演示用于纳米粒子的摇摆布朗马达
- 用于化学传感器的金纳米粒子
- 用于癌症治疗的纳米粒子:当前的进展和挑战
- 生物相容性 FePO4 纳米颗粒:药物递送、RNA 稳定和功能活性
- 用于神经保护的脑靶向聚山梨醇酯 80 乳化多奈哌齐载药纳米颗粒
- 加载白藜芦醇的白蛋白纳米颗粒具有延长血液循环和改善生物相容性的高效靶向胰腺肿瘤治疗
- 用于体内 CT 成像和肾脏清除特性的新型生物相容性 Au Nanostars@PEG 纳米颗粒
- 合成单分散二元 FePt-Fe3O4 纳米粒子的后处理方法
- 改性超支化聚甘油作为分散剂,用于控制和稳定碳氢化合物中的金纳米粒子
- 通过聚乙二醇化脂质体改善蟾蜍灵的抗肿瘤功效和药代动力学
- 用于光热疗法和光声成像的聚吡咯涂层铁铂纳米粒子的合成和体外性能
- 平台车的多种用途


