生物相容性 FePO4 纳米颗粒:药物递送、RNA 稳定和功能活性
摘要
FePO4 NPs 因其生物相容性、高生物利用度、磁性和优异的感官性能而在食品强化和生物医学成像方面具有特殊意义,不会引起不利的感官影响。这些特性在药物递送中也是可取的。在这里,我们探索了 FePO4 纳米颗粒作为抗癌药物阿霉素的递送载体,其最佳载药量为 26.81% ± 1.0%。这种加载进一步强制形成 Fe 3+ 阿霉素复合物导致 FePO4-DOX 纳米颗粒的形成。 FePO4-DOX 纳米颗粒显示出良好的尺寸均匀性和浓度依赖性生物相容性,在高达 80 µg/mL 的浓度下具有超过 70% 的生物相容性。重要的是,细胞毒性分析表明 Fe 3+ 在 FePO4-DOX NPs 中与 DOX 络合使细胞毒性比游离 DOX 提高约 10 倍,并提高了对癌细胞的选择性。此外,FePO4 NPs 温度稳定 RNA 并支持 mRNA 翻译活性,显示出对 RNA 稳定剂的承诺。结果表明铁基无机纳米粒子的生物相容性、它们的药物和 RNA 负载、稳定性和递送活性,对食品强化和药物/RNA 递送具有潜在影响。
介绍
在各种无机纳米粒子(如金、二氧化硅和量子点)中,铁基纳米粒子 (Fe-NPs) 被广泛用于生物医学应用,如造影剂、药物输送载体和热基治疗 [1,2,3]。由于铁的磁性、高生物适应性和已知的内源性代谢,Fe-NPs 是生物医学应用的理想候选者。因此,Fe-NP 是 FDA 批准的大多数无机纳米药物 [1, 2]。这些包括 INFeD、DexFerrum、Ferrlecit、Venofer、Feraheme 和 Injectafer,它们在商业上可用于治疗缺铁性贫血和慢性肾病缺铁 [1]。同样,螯合葡萄糖酸铁的静脉内给药是一种耐受性良好的贫血干预措施 [4]。贫血是世界上最普遍的营养缺乏症之一,FePO4 和 FeSO4 等铁基纳米颗粒已被用于食品强化以预防贫血。食品强化是在食品中添加微量营养素的过程,旨在克服人群中的营养缺乏[5]。 FePO4 NPs 因其生物相容性、高生物利用度和卓越的感官性能而在食品强化方面受到特别关注,不会导致不利的感官影响 [6,7,8,9]。完美等。已经证明 FePO4 NPs 在人肠细胞中的内化主要通过二价金属转运蛋白 1 (DMT-1) 发生,因此很容易被吸收 [9, 10]。铁基 Feridex® 和 Revosit® 是广泛用于增强 MRI 的磁共振成像 (MRI) 造影剂 [11,12,13,14,15,16]。鉴于这些出色的报告,FePO4 NPs 将自己展示为一种很好的载体。在这里,我们通过加载抗癌药物多柔比星 (DOX) 来探索 FePO4 作为药物递送载体。三价铁离子 (Fe 3+ ) 可以通过 FePO4 中缺电子 Fe 和 DOX 中富电子 -OH 基团之间的静电相互作用与 DOX 分子形成复合物,形成负载 DOX 的 FePO4 NPs:FePO4-DOX NPs。我们评估了 FePO4 和 FePO4-DOX NPs 的理化性质,并分别评估了它们在小鼠骨肉瘤 K7M2 和成纤维细胞 NIH/3T3 细胞系中的生物相容性和细胞毒性。
与此同时,无机纳米颗粒在核酸稳定和递送方面显示出前景 [17,18,19]。在这方面,金纳米颗粒已被广泛研究,因为它们能够将寡核苷酸固定在其表面,从而防止分子聚集和降解 [17, 20]。然而,金不是内源性元素,因此可能会限制其转化应用。在这里,Fe 基纳米粒子(如 FePO4 纳米粒子)由于其内源性和已建立的生物相容性特征而成为 RNA 稳定研究的主要关注点。核酸 (RNA/DNA) 与 Fe-NPs 相互作用的两种机制被认为是稳定的——(1) 形成氢键和核酸骨架的磷酸基团与 Fe-NPs 之间的静电相互作用导致核酸吸附Fe-NPs 中的酸,以及 (2) 核酸可以通过核苷酸碱基对相互作用吸附到 Fe-NPs 表面 [19, 21, 22]。一项研究显示了磷酸钙纳米颗粒在 DNA 疫苗稳定和递送方面的潜力 [23]。在这方面,我们探索了另一种磷酸盐基纳米颗粒 FePO4 的 RNA 稳定性和功能活性,以研究基于 FePO4 的纳米颗粒在运输和稳定货物方面的多功能潜力。
随着针对 COVID19 的 mRNA 疫苗的快速批准,mRNA 疫苗纳米颗粒引起了人们极大的兴趣,RNA 会快速水解并丧失功能表达,因此纳米颗粒有责任改善这些关键特性。在这里,我们展示了 FePO4 NPs 稳定 RNA 并支持功能性 mRNA 翻译。鉴于这些优异的特性,FePO4 NPs 可能值得考虑用于食品强化、药物和 RNA 输送,开辟令人兴奋的生物医学应用。
结果与讨论
FePO4 NPs 合成、表征和生物相容性分析
(NH4)3PO4 和 Fe(NO3)3 之间的简单一步化学反应得到 FePO4 作为沉淀物,它分散在生物相容性脂质-PEG 表面活性剂中,有助于稳定 FePO4 纳米粒子并防止聚集。 FePO4 NPs 的流体动力学尺寸为 175 ± 5 nm,多分散指数 (PDI) 为 0.150 ± 0.01,表明良好的颗粒均匀性和窄尺寸分布。 Zeta 电位分析显示 FePO4 NP 的表面负电荷为 - 19.1 ± 8 mV zeta 电位。负表面电荷进一步有助于稳定胶体中的颗粒,从而防止蛋白质调理作用,这是一种阻止细胞靶向并改变药代动力学的机制 [24,25,26]。 FePO4 进一步通过 FTIR 表征。图 1c 显示了 FePO4 纳米颗粒及其前体——Fe(NO3)3 和 (NH4)3PO4 的光谱特性。 FePO4 光谱在 1030 cm -1 处显示出明显的尖峰 这可以归因于 P-O 伸缩带,在 520 cm -1 处有一个小峰 对应于 O-P-O 反对称弯曲,范围从 3000 到 3500 cm -1 表示来自吸附水分子的水弯曲和伸缩振动 [27, 28]。 FePO4 光谱表明存在 PO4 3− 组并且与其他研究报告的 FTIR 峰相似,从而证实了 FePO4 纳米粒子的形成 [27,28,29]。 Fe(NO3)3 光谱在 1326 和 813 cm -1 处显示了 N-O 伸缩带的特征峰 [30]。 1625 处的峰可归因于 –OH 弯曲振动和 3000 cm 附近的宽峰 -1 可归因于水的弯曲和拉伸振动 [30]。同样,(NH4)3PO4 在 1500 cm -1 附近显示出铵基的特征峰 和磷酸基团大约 1000 cm -1 [31]。 FePO4纳米颗粒中没有硝酸盐和铵峰,表明该产品不含可能的副产物,证实了合成的纯度。
<图片>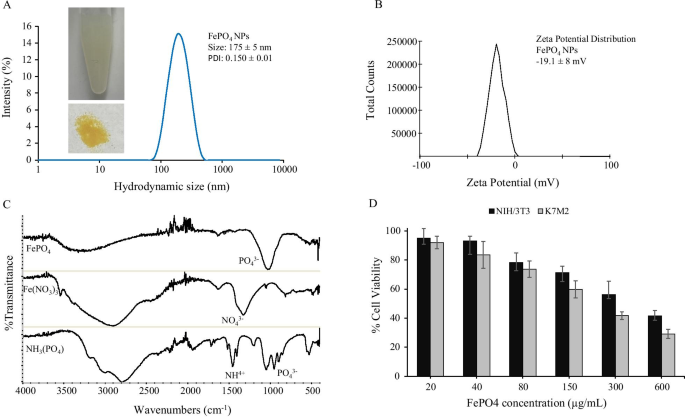
FePO4 纳米粒子的表征和生物相容性。 一 FePO4 NPs的流体动力学尺寸分布,b FePO4 NPs 的 zeta 电位测量显示表面电荷,c FePO4 NPs及其前体-Fe(NO3)3和(NH4)3PO4以及d的FTIR FePO4 NPs 对小鼠骨肉瘤 K7M2 和小鼠成纤维细胞 NIH/3T3 细胞系的生物相容性。 NPs 在不同浓度下处理 48 小时 (a, b 数据代表平均值 ± s.d.; n =3 个重复。 d 表示均值 ± s.d.,n =6 个重复)。
在保证 FePO4 NPs 合成成功、纯度高、尺寸均匀性好和表面电荷稳定的情况下,我们继续分析 FePO4 NPs 的生物相容性。为此,我们使用了癌细胞和非癌细胞:小鼠骨肉瘤 K7M2 和小鼠成纤维细胞 NIH/3T3,并使用 MTT 测定分析了不同浓度的 NPs 在细胞活力方面的生物相容性。 FePO4 NPs 在 20 至 600 µg/mL 的浓度范围内,在细胞系 K7M2 和 NIH/3T3 中均显示出浓度依赖性生物相容性(图 1d)。 FePO4 NPs 在浓度高达 80 µg/mL 时表现出良好的生物相容性,细胞活力大于 70%。与癌细胞K7M2相比,非癌细胞NIH/3T3的生物相容性相对较高。
FePO4 中的阿霉素负载和 FePO4-DOX 的细胞毒性
多柔比星通过共孵育-沉淀法加载到 FePO4 中,其中多柔比星溶液与 FePO4 的前体混合,导致形成加载 DOX 的 FePO4。如方法中所讨论的,采用三种不同的配方来加载 DOX。配方 1 显示最佳加载效率为 26.81% ± 1,而配方 2 显示加载效率为 8.83% ± 2,而配方 3 没有显示任何加载(图 2a)。对于负载,我们将 DOX 溶液添加到配方 1 中的前体 Fe(NO3)3 和配方 2 中的 (NH4)3PO4 中,而在配方 3 中,我们直接将 DOX 溶液添加到 FePO4 NPs 中。加载数据清楚地表明,将 DOX 添加到 FePO4 NPs 不会保留 DOX,而将 DOX 添加到任一前体:Fe(NO3)3 和 (NH4)3PO4 溶液有助于加载和保留 DOX。这可以解释为 Fe 3+ 来自 Fe(NO3)3 的可与多柔比星中存在的富电子氧基团形成复合物 [32, 33]。 Fe 3+ 然后通过添加 (NH4)3PO4 沉淀 -DOX 复合物,产生 FePO4-DOX,其特征是颜色从淡黄色变为淡褐色(图 2b)。尽管颜色发生了变化,但 FePO4-DOX 的发射光谱没有变化,当在 480 nm 激发时,其在 590 nm 处的发射最大值与游离 DOX 的发射光谱相似(图 2c)。 FePO4-DOX NPs 的流体力学尺寸为 187 ± 7 nm,PDI 为 0.143 ± 0.02,与 FePO4 相似(图 2d)。然而,与 FePO4 NP (-19.1 ± 8 mV) 相比,FePO4-DOX NPs (-8.89 ± 5 mV) 的表面电荷存在显着差异(图 2e)。 zeta 电位的变化表明纳米粒子表面性质的功能变化。在这里,zeta 电位从- 19.1 降低到- 8.89 mV 可归因于 DOX 络合,这增加了络合物中的阳离子特性。
<图片>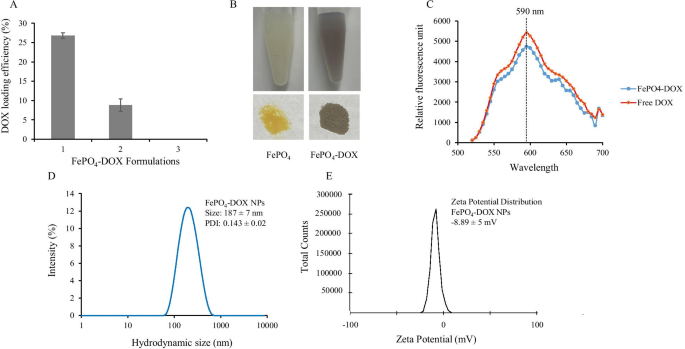
FePO4 NPs 中的阿霉素 (DOX) 负载和 FePO4-DOX 的表征。 一 三种不同配方的 FePO4 NPs 和 DOX 中的 DOX 负载效率,b 在 FePO4 中负载 DOX 以配制 FePO4-DOX 后颜色从黄色变为棕色的图形表示,c 在 480 nm 激发后加载 DOX 的 FePO4 NPs (FePO4-DOX) 的发射光谱表征,d FePO4-DOX NPs 的流体动力学尺寸分布,以及 e FePO4-DOX NPs 的 zeta 电位表征显示表面电荷(数据代表平均值 ± s.d.;n =3 次重复)
在物理化学表征之后,在 K7M2 和 NIH/3T3 细胞中分析 FePO4-DOX 的细胞毒性,并与游离 DOX 进行比较(图 3)。在两种细胞系中,当 DOX 浓度相同时,FePO4-DOX 与游离 DOX 相比显示出更高的细胞毒性。通过 FePO4-DOX 处理,IC50 值降低了约 10 倍,NIH/3T3 中从 2.61 到 0.248 µM,K7M2 细胞中从 1.01 到 0.107 µM。两种细胞系中 IC50 值的这种急剧下降表明 FePO4-DOX NP 的细胞毒性特征增强。 FePO4-DOX 的 IC50 浓度范围内的等效 FePO4 浓度为 40 µg/mL(K7M2 细胞中为 0.107 µM)和 100 µg/mL(NIH/3T3 细胞中为 0.248 µM),它们都在 FePO4 浓度的生物相容性范围内, 具有超过 70% 的细胞活力。因此,FePO4-DOX 细胞毒性的升高可归因于 Fe 3+ -DOX 复合物的形成而不是 FePO4 和 DOX 的单独贡献。文献表明,在铁存在下,蒽环类药物(如阿霉素)的细胞毒性作用会升高 [34,35,36,37]。通过使用铁螯合剂减轻 Fe-DOX 细胞毒性进一步支持了这些报告 [35,36,37]。一种提出的机制是 Fe-DOX 复合物增强了 DOX 衍生的活性氧 (ROS) 转化相对安全的 ROS (O 2· – 和 H2O2) 转化为毒性更大的 ROS,导致 DNA 损伤和细胞死亡升高 [34, 36]。另一个提出的机制是在过量 Fe 存在下,DOX 与铁调节蛋白和铁蛋白的功能相互作用,从而影响铁稳态,导致 ROS 依赖性和独立的损伤和细胞凋亡 [36, 38]。
<图片>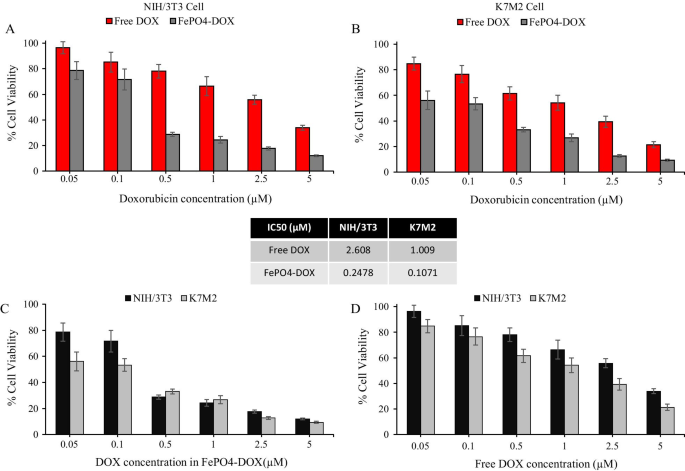
FePO4-DOX NPs 的细胞毒性。 a, b 游离多柔比星 (DOX) 和 FePO4-DOX NPs 在小鼠成纤维细胞 NIH/3T3 和骨肉瘤 K7M2 细胞系中的细胞毒性,分别在不同的 DOX 等效浓度下。在粒子处理 48 小时后以百分比细胞存活率分析细胞毒性。 c, d 在等效 DOX 浓度下,分别比较 NIH/3T3 和 K7M2 细胞系中 FePO4-DOX NPs 和游离 DOX 的细胞活力百分比。中间的插图代表 NIH/3T3 和 K7M2 细胞中游离 DOX 和 FePO4-DOX NPs 的 IC-50 值(数据代表平均值 ± s.d.;n =6 次重复)
随着细胞毒性的提高,FePO4-DOX 对癌细胞具有更高的细胞毒性,类似于游离 DOX。图 3c 显示 0.1 µM DOX 等效 FePO4-DOX 显示癌细胞 K7M2 的细胞存活率为 53%,而非癌症 NIH/3T3 的细胞存活率为 72%。同样,Free DOX 也对癌细胞表现出更高的细胞毒性行为,K7M2 细胞中的细胞活力为 54%,而 NIH/3T3 中为 66%。然而,FePO4-DOX 的差异有所增加,癌细胞和非癌细胞之间的细胞活力差异为 19%,而游离 DOX 为 12%。细胞毒性分析表明,FePO4-DOX NPs中Fe与DOX的络合显着增强了细胞毒性,提高了对癌细胞的选择性。
FePO4-DOX NPs 的细胞内化
在时间依赖性内化研究之后,使用共聚焦显微镜分析 FePO4-DOX NPs 的内化行为(图 4)。游离 DOX 用作阳性对照。 FePO4-DOX NPs 和游离 DOX 在最初的 0.5 和 1 小时孵育时间点都没有表现出显着的内化。然而,在 3 小时孵育时,两者都显示出内化,如共焦图像中的红色 DOX 荧光所示。蓝色来自 DAPI 的细胞核染色。分析表明,在 3 小时内,FePO4-DOX NP 会按照与游离 DOX 类似的内化行为内化到细胞中。值得注意的是,由于 FePO4-DOX 的颜色变化,与 Free DOX 的红色相比呈褐色,我们可能无法定量比较 FePO4-DOX 的相对内化曲线。尽管如此,内化测定证实 FePO4-DOX 在 3 小时内被细胞摄取。鉴于我们的身体对铁的处理机制已经很好理解,所提出的 NPs 有望用于开发基于铁的抗癌疗法,并能够在单次治疗中监测治疗反应。
<图片>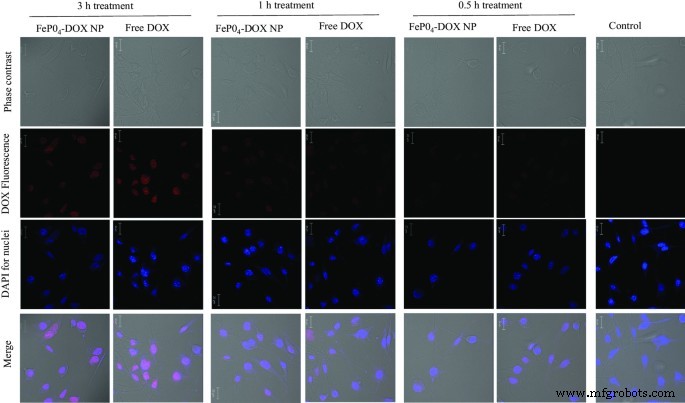
细胞内化研究。处理 3 小时、1 小时和 0.5 小时后,FePO4-DOX NP 和游离 DOX 在 K7M2 细胞上的细胞内化。用 200 µL 浓度为 5 µg/mL 的 DOX 处理细胞。在纳米颗粒处理的细胞系中观察到的红色表示纳米颗粒的成功内化。红色是由于 DOX 的荧光特性。未处理的对照细胞未观察到红色信号
RNA 稳定和 mRNA 表达
如图 5a 所示,虽然铜纳米粒子 (Cu NP) 和碳纳米管 (CNT) 加速了 RNA 水解降解(带强度低于对照),但 FePO4 和对照银(Ag)纳米粒子稳定了 RNA,如图所示RNA 琼脂糖凝胶电泳 (RAGE) 中的强条带强度。 FePO4 和对照氧化锌纳米颗粒 (ZnO NP) 也赋予了一些对血清降解的抵抗力,如带强度所示,略高于对照(图 5b)。重要的是功能活性,mRNA 表达高于非纳米颗粒对照,而 RNA 降解的 Cu NP 导致 mRNA 表达的损失,如相对光单位所测量的(图 5c)。这些结果表明,FePO4 NPs 有助于稳定 RNA,并可用作治疗性 RNA 递送的稳定递送剂。较早的初步实验表明正常的翻译工作范围是针对对照非纳米粒子处理的样品的两个独立实验,显示具有代表性的 2393 和 2630 RLU/孔。与上述数据一致的两倍增加表明 FePO44 NP 支持翻译,而与上述 RNA 变性/降解一致,Cu NP 抑制翻译。多种无机纳米颗粒系统已被用于治疗性 RNA 稳定和递送,包括:金、银、铜、氧化铁、介孔二氧化硅纳米颗粒 (MSN)、碳基聚合物、复合材料等 [39-45]。例如,我们小组曾报道纳米颗粒与大分子 RNA 的复合可使其抵抗 RNase 或血清和组织中存在的核酸酶的降解。 COVID-19 mRNA 疫苗重新引起了人们对这种超越疫苗的大分子 RNA 疗法的兴趣,其中纳米颗粒不仅有责任保护 RNA 免于水解和核酸酶介导的消化,而且与 NP 的络合必须保持 RNA 功能,例如, mRNA 表达。之前我们已经看到铜纳米颗粒复合大分子 RNA 会导致 RNA 变性 [46] 因此我们使用圆环酵母 RNA (TY-RNA) 或表达荧光素酶的报告基因构建体 mRNA 研究了 NP 复合对大分子 RNA 的影响。
<图片>
RNA水解。 一 我们在许多出版物中使用的模型 RNA 在大小和序列组成上与来自圆环酵母 (TY-RNA) 的大多数 mRNA 相似。在存在或不存在纳米粒子铜 (Cu NP)、磷酸铁 (FePO4)、银 (Ag NP) 或碳纳米管 (CNT) 的情况下,将 RNA 在双蒸水中在 37 摄氏度下随时间培养,并在同一时间点并通过 RNA 琼脂糖凝胶电泳 (RAGE) 进行测定。条带染色强度的损失表明 RNA 降解,而 RNA 条带染色强度的维持表明稳定。 b 与上述类似,在室温下,在氧化锌 (ZnO) NP 或 FePO 4 NP 存在下,RNA 在 10% FBS/DMEM 中孵育,而对照是在没有纳米颗粒的情况下单独的 RNA。随着时间的推移再次取出样品并通过 RAGE 进行分析,随着时间的推移,染色的 RNA 条带的存在再次表明稳定性和对核酸酶或 RNase 从血清降解的抵抗力。 c 在体外从标准兔网织红细胞中翻译出编码荧光素酶的 mRNA,在磷酸铁 (FePO4) 或铜 (Cu) 纳米颗粒存在或不存在的情况下,将相对发光标准化为 RNA
结论
FePO 4 纳米颗粒通过简单的共孵育-沉淀技术成功合成,导致形成175 ± 5nm的均匀尺寸颗粒。 FTIR 分析证实了纳米颗粒中存在磷酸基团并且不存在前体杂质。生物相容性分析揭示了浓度依赖性的生物相容性,高达 80 µg/mL 的细胞活力超过 70%。此外,DOX 有效地负载在 FePO4 中,导致 FePO4-DOX NPs 显示出与 FePO4 相似的物理化学性质。细胞毒性分析表明,FePO4-DOX NPs 中 Fe 与 DOX 的络合增强了细胞毒性,IC50 提高了约 10 倍,并提高了对癌细胞的选择性。此外,内化分析表明,FePO4-DOX NPs 在 3 小时孵育时间点被有效地内化到细胞中。 RNA 稳定化研究表明,FePO4 纳米颗粒可有效稳定 RNA,防止快速降解并保持功能活性,这证明了递送治疗性 RNA 的前景。鉴于良好的尺寸均匀性、生物相容性范围、载药效率、增强的细胞毒性、RNA 稳定特性和有效的细胞摄取,FePO4 NPs 显示出理想的药物和 RNA 递送载体特性。此外,该结果显示了在食品强化中使用 FePO4 药物 NPs 以开发基于食品的药物平台的广阔前景。
方法
FePO4 纳米颗粒的合成与表征
FePO4 纳米粒子是由 Sokolova 等人通过化学沉淀技术优化方案合成的。 [47]。简而言之,制备磷酸铵((NH4)3PO4,16mg/mL)和硝酸铁(Fe(NO3)3,8mg/mL)溶液。在持续搅拌下向 1 mL Fe(NO3)3 中滴加 1 mL (NH4)3PO4,导致磷酸铁 (FePO4) 沉淀。使用了过量的 (NH4)3PO4,从而使 Fe(NO3)3 中的所有 Fe 以 FePO4 的形式沉淀。由此形成的磷酸铁溶液用水洗涤 3 次以通过以 300 g 离心 2 分钟去除副产物。最后,将 FePO4 沉淀物用 DSPE-PEG-COOH 溶液(10% w/w)分散在水中以配制 FePO4 纳米颗粒。使用动态光散射 (DLS) 和傅里叶变换红外光谱 (FTIR) 对 FePO4 NPs 的尺寸和表面性质进行表征。
FePO4 纳米颗粒上的阿霉素 (DOX) 负载
通过共孵育-沉淀法将阿霉素负载在 FePO4 纳米颗粒中。探索了三种不同的 DOX-FePO4 NPs 配方以优化最佳加载效率。在第一个配方中,通过在 1 mL Fe(NO3)3 (8 mg/mL) 中加入 100 µg DOX 然后滴加 1 mL (NH4)3PO4 (16 mg/mL) 来配制 DOX-FePO4 NP在不断搅拌下。在第二个配方中,首先将 100 µg DOX 添加到 1 mL (NH4)3PO4 (16 mg/mL) 中,然后在持续搅拌下逐滴添加 1 mL Fe(NO3)3 (8 mg/mL)。在第三个配方中,将 100 µg DOX 添加到 FePO4 NP 溶液中。如此配制的 FePO4-DOX NPs 用水洗涤 3 次,通过在 490 nm 和 595 nm 处测量 DOX 激发和发射,通过分光荧光法定量分析 FePO4-DOX 中阿霉素的含量。
DOX加载效率由下式计算:
$$\% \;{\text{Loading}}\;{\text{效率:}}\;\left( {{\text{DOX}}\;{\text{present}}\;{\text { in}}\;{\text{ FePO}}_{{4}} - {\text{DOX}}\;{\text{NP/Initial}}\;{\text{input}}\;{ \text{of}}\;{\text{DOX}}} \right) \times {1}00$$FePO4 NPs 的生物相容性和 FePO4-DOX NPs 的细胞毒性
FePO4 NPs 的生物相容性和 FePO4-DOX NPs 的细胞毒性在小鼠骨肉瘤 K7M2 和小鼠成纤维细胞 NIH/3T3 中使用 MTT 测定按照既定的方案进行测定 [48, 49]。简而言之,将 10,000 个细胞接种在 96 孔板中并在 37°C 5% CO2 培养箱中培养 24 小时。然后,去除培养基并将具有不同浓度纳米颗粒的新鲜培养基处理成细胞并放置孵育 48 小时。对照细胞仅用培养基维持。 FePO4 NPs 浓度范围为 20 至 600 µg/mL,DOX 浓度范围为 0.05 至 5 µM。 NP 温育后,去除培养基并将细胞与无血清培养基中的 MTT 溶液 (0.5 mg/ml) 温育 2 小时以形成甲臜晶体。去除 MTT 溶液,将甲臜晶体溶解在 DMSO 中,并在室温下放置 15 分钟以进行适当混合。然后使用酶标仪(BioTek,Synergy H1 Hybrid Reader)在550 nm处测量DMSO溶液的吸光度并计算细胞活力百分比。
通过共聚焦显微镜进行细胞内化
使用共聚焦显微镜在小鼠骨肉瘤 K7M2 细胞中分析 FePO4-DOX NPs 的细胞内化 [49,50,51]。简而言之,将 12,000 个细胞接种在 8 孔板中,并在 37°C 5% CO2 培养箱中培养 24 小时。然后,将 200 µL 浓度为 5 µg/mL 的 DOX 在培养基中处理 3 小时,并用 4% 多聚甲醛固定细胞以进行成像。细胞核通过 DAPI 染色,并在共聚焦激光扫描显微镜 (Carl Zeiss, LSM-700) 下观察细胞。在这里,可以利用 DOX 在 560 nm 处的最大发射来跟踪其内化,这在共聚焦显微镜下呈现红色。使用相同的方案,通过将 FePO4-DOX NPs 和游离 DOX 分别孵育 0.5、1 和 3 小时来进行时间依赖性内化测定。
RNA 稳定性和表达
Torula 酵母 RNA (Sigma-Aldrich) 以 1 mg/ml 的浓度溶解在无菌去离子水中,将 2 μg 等分试样暴露在 20 ug/mL 纳米颗粒(CNT、Cu、Ag、ZnO NP 或 FePO4)中,在 37 摄氏度下孵育并通过正如我们之前报道的那样,通过 RNA 琼脂糖凝胶电泳确定时间 [42, 52]。图 5 中所示的时间点是过夜。类似地,将含有/不含纳米颗粒的 RNA 暴露于 10% FBS/DMEM 中,并再次通过 RAGE 进行分析,如上。 mRNA fLuc 来自 Trilink Biotechnologies,将 2 µl 在添加了甲氨酸、半胱氨酸和亮氨酸(ProMega Corp)的兔网状糖蛋白中孵育 30 度 1.5 小时,使用或不使用 20 μg/ml 的纳米颗粒,添加标准荧光素试剂,并进行发光测量在标准条件下在 Biotek Synergy H1 读板机上拍摄。
统计分析
所有数据代表至少三个独立的重复,并表示为平均值 ± s.d。只要有可能。细胞活力数据包括六次重复。
数据和材料的可用性
当前研究中使用和/或分析的数据集可根据合理要求向相应作者索取。
纳米材料
- 用于增强药物递送的纳米纤维和细丝
- 131I 追踪的 PLGA-脂质纳米颗粒作为靶向化疗治疗黑色素瘤的药物递送载体
- Sb/坡缕石 (PAL) 纳米颗粒的制备和增强催化氢化活性
- 纳米技术:从体内成像系统到受控给药
- 用于体内 CT 成像和肾脏清除特性的新型生物相容性 Au Nanostars@PEG 纳米颗粒
- 改性超支化聚甘油作为分散剂,用于控制和稳定碳氢化合物中的金纳米粒子
- 使用表面光谱分析测定过渡金属掺杂的 TiO2 纳米颗粒的催化活性
- 用于光热疗法和光声成像的聚吡咯涂层铁铂纳米粒子的合成和体外性能
- 铜纳米粒子合成和稳定方面的环保能力:催化、抗菌、细胞毒性和抗氧化活性
- 原位制备的壳聚糖/银纳米颗粒溶液对耐甲氧西林金黄色葡萄球菌菌株的抗菌活性
- 金属和金属氧化物纳米粒子的绿色合成及其对单细胞藻类莱茵衣藻的影响
- 氧化锌纳米粒子的特性及其对微生物的活性


