评估金纳米颗粒抑制的细胞色素 P450 3A4 活性及其在人肝细胞癌细胞系 C3A 中的细胞毒性的分子机制
摘要
已经研究了用阳离子支化聚乙烯亚胺 (BPEI)、阴离子硫辛酸 (LA) 或中性聚乙二醇 (PEG) 功能化的 40 和 80 nm 金纳米粒子 (AuNP) 与人肝细胞癌 (HCC) 细胞系 C3A 的相互作用。人血浆蛋白冠 (PC) 的缺失和存在。除了 80 nm LA-AuNP 之外的所有裸(无 PC)AuNP 对 C3A 都具有细胞毒性,但 PC 减弱了它们的细胞毒性。除了 40 nm BPEI-AuNP 外,AuNP 的时间依赖性细胞摄取增加,但 PC 抑制了除 80 nm PEG-AuNP 之外的它们的摄取。 BPEI-AuNP 对氧化/亚硝化应激的双相反应发生在 C3A 细胞中,而 PEG-AuNP 是一种有效的抗氧化剂。无论大小和表面电荷如何,所有裸 AuNP 均抑制细胞色素 P450 (CYP) 3A4 的活性,但除 PEG-AuNP 外,PC 还恢复了其活性。 40 nm PEG-AuNP 调节的基因表达主要参与线粒体脂肪酸β-氧化,并在较小程度上参与肝脏外排/摄取转运蛋白。这些研究有助于更好地了解AuNP与HCC中关键生物学过程的相互作用及其潜在分子机制,这可能有助于开发更有效的HCC治疗靶点。
背景
肝细胞癌 (HCC) 是全球最常见的癌症之一,也是美国癌症死亡率增长最快的原因 [1, 2]。鉴于 HCC 已在晚期被诊断出来,治愈性 HCC 治疗包括在肿瘤发展的早期进行肝移植或手术切除,以及针对晚期肿瘤的化疗和放疗。 HCC 经常对常规抗肿瘤药物产生高度耐药性,这是一种非选择性细胞毒性分子,可能导致全身不良反应。基因治疗的最新进展,即基于 RNA 干扰 (RNAi) 的基因治疗,已被用于当前的 HCC 治疗 [3, 4]。 RNAi 的功效需要将载体递送到靶细胞内部 [5]。成功传递基因的载体是病毒和非病毒载体。病毒提供更高的基因传递效率,但由于病毒载体的安全性问题,首选非病毒载体。纳米颗粒 (NP) 作为用于靶向基因递送或药物递送系统的非病毒载体在 HCC 治疗中提高治疗效率和降低全身和/或细胞水平的毒性得到了极大的关注 [4, 6]。因此,确定NP在靶细胞和组织中的细胞干扰和毒性的分子机制和生物学途径变得非常重要。最近的体外研究表明,基因表达谱结合细胞和生化反应可以直接评估细胞扰动和潜在的纳米颗粒毒性 [7,8,9,10]。
由于其独特的物理化学性质和表面化学性质,金纳米粒子 (AuNP) 已被用作基因沉默部分的靶向特异性递送的递送载体,单独或与其他药物联合使用 [11, 12]。 AuNP 与血浆蛋白相互作用形成蛋白冠,这反过来改变 NP 表面化学并影响随后的生物反应,如细胞摄取和潜在毒性 [13, 14]。无论大小和表面电荷如何,AuNP在不同人类癌细胞系和原代细胞中的细胞摄取都受到蛋白质电晕形成的严重影响[7,8,9,14,15,16,17]。
在人乳腺癌细胞系、MDA-MB-231、肝细胞癌 HepG2 和人白血病 HL-60 细胞中也观察到了大小和表面电荷依赖性氧化应激,这些细胞对 AuNP 有反应,这与 NP 细胞毒性有关 [18] , 19]。 AuNP 诱导的细胞毒性以细胞类型特异性的方式发生在各种人类癌细胞系和原代人类细胞中 [7,8,9,20,21]。
细胞色素 P450 (CYP) 酶在许多细胞毒性药物的生物活化或失活以及宿主对抗癌药物致癌性的易感性中起重要作用 [22]。 AuNP 在体内和体外在细胞和分子水平上影响 CYP 酶的催化活性 [7, 23,24,25]。 AuNP 显着地表现出差异基因表达,主要涉及人肺成纤维细胞系 MRC-5 中的氧化应激标志物,以及人脐静脉细胞 (HUVEC) 和人肝细胞中的线粒体功能障碍,这与脂质过氧化物产生的增加和高细胞毒性 [8, 9, 26]。虽然这些知识反过来表明 AuNP 会导致各种细胞类型的细胞凋亡或坏死,并改变细胞和生化功能以及应激反应途径和毒性中的差异基因表达,但 AuNP 在细胞或生物体内发挥毒性作用的特定途径系统未知。
在此,本研究调查了蛋白质电晕、大小和表面电荷对 AuNP 与人 HCC 细胞 C3A 相互作用的影响。首先,在使用和不使用人血浆蛋白冠 (PC) 的情况下,确定了 C3A 细胞中用阳离子 BPEI、阴离子硫辛酸 (LA) 或中性聚乙二醇 (PEG) 功能化的 40 和 80 nm AuNP 的时间依赖性细胞摄取。其次,监测 AuNP 诱导的细胞毒性和活性氧 (ROS)/活性氮 (RNS) 的产生以及它们对 CYP3A4 活性的抑制作用。最后,使用人类分子毒理学通路查找器和人类药物转运蛋白 RT 2 表征了 AuNP 毒性相关的分子作用机制 Profiler™ PCR 芯片。
方法
金纳米粒子合成
40 和 80 nm 阳离子 BPEI、阴离子 LA 和中性 PEG Biopure™ AuNP 是从 nanoComposix(加利福尼亚州圣地亚哥)定制合成的。通过动态光散射 (DLS)、透射电子显微镜 (TEM) 和 UV-Vis 光谱表征粒度、多分散指数 (PDI) 和 zeta (z) 电位和光谱特性。 AuNP是通过在碳酸钾水溶液中还原四氯金酸氢(III)水合物,然后进行老化过程和切向流过滤(TFF)合成的。通过添加二氢硫辛酸 (0.2:1, w /w ) 或巯基甲氧基封端的 PEG (Laysan Bio Inc., Arab, AL) (0.5:1, w /w ),然后分别进行 TFF 洗涤和无菌过滤。通过 EDC 化学合成 BPEI 功能化的 AuNP 表面,将 LA 的羧酸与 BPEI 的游离胺相连,然后进行 TFF 洗涤,然后离心去除未结合的 BPEI。
蛋白质电晕制备
混合人血浆 (n =5) 来自 Biological Specialty Corp. (Colmar, PA)。 AuNP 在人血浆 (55%, v /v ) 在 37°C 下以 250 rpm 的恒定速度运行 1 小时 [7, 8]。通过用磷酸盐缓冲盐水 (PBS) 以 20,000×g 重复洗涤去除未结合的和弱结合的蛋白质 在 20°C 下保持 20 分钟。最终的人血浆蛋白电晕 (PC) 包被的 AuNP 分散在 PBS 中,然后在细胞培养基中稀释,用于进一步的物理化学表征或给药。详细的协议在附加文件 1 中给出。
AuNP 的物理化学表征
流体动力学直径 (D H)、PDI 和 40 和 80 nm 裸(无 PC)AuNP 在去离子 (DI) 水中用 BPEI、LA 和 PEG 功能化的 Z 电位,在 25°C 和 0 小时使用 Zetasizer Nano ZS 进行分析( Malvern Instruments,英国伍斯特郡);对于 PBS 中的 PC 涂层 AuNP,在 25°C 下 0 小时;对于在 37°C 下 0 小时和 24 小时的完整细胞培养基中的所有裸金和 PC 金纳米粒子。完全细胞培养基含有 Eagle 最低必需培养基 (EMEM),并补充有 10% FBS (ATCC ® ,弗吉尼亚州马纳萨斯)。一个样品测量了 5 次,每次 10 秒,有 11 个子运行。此外,使用 Synergy H1 混合多模式酶标仪(BioTek Instruments Inc.,Winooski,VT)在室温下 0 小时测量光吸收光谱。
透射电子显微镜
使用 TEM 表征 AuNP 形貌。所有裸露和 PC AuNP 溶液 (5 μL) 都放置在 200 目铜网上,然后在室温下风干。样品在 Tecnai G2 Spirit BioTWIN 上以 120 kV 的加速电压观察,带有牛津检测器(FEI Company, Hillsboro, OR)。 GATAN 显微镜套件(GATAN Inc., Pleasanton, CA)测量 AuNP 直径。
细胞培养和活力测量
人肝细胞癌 C3A 细胞 (ATCC ® CRL-10741™) 购自 ATCC ® (弗吉尼亚州马纳萨斯),在完全 EMEM (ATCC ® , Manassas, VA) 补充 10% FBS,并在 T75 烧瓶中扩展到大约 80% 汇合,每 4 天更换一次培养基。 0.25% (w /v ) 胰蛋白酶–0.53 mM 乙二胺四乙酸 (EDTA) 消化,将细胞以 8 × 10 4 接种于 96 孔板中 细胞每孔并在 37°C 下在 95% 空气和 5% CO2 的潮湿气氛中培养。孵育 48 小时后,在 PC 存在和不存在的情况下,向细胞中加入 AuNP。使用第9代和第12代之间的C3A细胞进行给药。
使用 alamarBlue ® 测定 C3A 活力 活力测定(Thermo Sci., Waltham, MA)如所述 [7, 27]。 96 孔板中的细胞用 40 和 80 nm BPEI-、LA-和 PEG-AuNP 处理,有和没有 PC 范围从 0 到 250 μg/cm 2 . 24 小时后,10% 的 alamarBlue ® 完全 EMEM 中的试剂 (v /v ) 加入细胞培养物中并在 37°C 下孵育 3 小时。完整的 EMEM 用作分散剂。 AuNP与alamarBlue ® 活性成分的相互作用 试剂、刃天青或还原产物试卤灵作为对照进行测量。 AuNP 和刃天青(无细胞)或维持培养基(无细胞)用作背景对照。与细胞活力成正比的荧光被标准化为对照,并表示为相对于对照细胞组的百分比。
使用电感耦合等离子体质谱法进行细胞摄取测量
细胞以8 × 10 4 接种 96 孔板每孔细胞数,无毒浓度为 1.56 μg/cm 2 0.5、1、3、6、12 和 24 小时的所有裸露和 PC AuNP。加入蚀刻步骤以去除细胞膜结合的 AuNP 及其与孔的非特异性结合,如先前报道的 [28]。细胞收获物在王水中干燥和消化,并使用 NexION ™ 量化细胞内金浓度 350X 电感耦合等离子体质谱 (ICP-MS)(珀金埃尔默,沃尔瑟姆,马萨诸塞州)。 AuNP 的细胞吸收按先前报道的方式计算,并表示为每个细胞的 AuNP 数量 [29]。详细的协议在附加文件1中给出。
氧化/亚硝化压力测量
细胞以8 × 10 4 接种 96 孔板的每孔细胞数,并加入 40 nm 裸 BPEI-和 PEG-AuNP,浓度高达 125 μg/cm 2 1、3 和 24 小时。如前所述 [30],使用总活性氧 (ROS)/超氧化物 (SO) 测定试剂盒 (Enzo Life Sciences, Farmingdale, NY) 测定氧/亚硝化应激的直接测量。使用酶标仪测量与 ROS/活性氮物质 (RNS) (Ex488/Em520 nm) 或 SO (Ex550/Em610 nm) 的增加成正比的荧光。详细的协议在附加文件1中给出。
细胞色素 P450 3A4 活动
40 和 80 nm 裸露和 PC AuNP 对 CYP3A4 活性的不利影响使用 P450-Glo™ 分析(Promega Corp.,麦迪逊,威斯康星州)进行表征 [7]。 96 孔板中的 C3A 细胞以中位致死浓度 (LC50) 值给药:127.3 μg/cm 2 40 nm BPEI-AuNP,205.5 μg/cm 2 80 nm BPEI-AuNP,192.5 μg/cm 2 40 nm LA-AuNP 和 129.5 μg/cm 2 40 nm PEG-AuNP。由于 80 nm LA- 和 PEG-AuNP 的 LC50 值未确定,细胞用 40 nm LA- 和 PEG-AuNP 的 LC50 值(192.5 μg/cm 2 和 129.5 μg/cm 2 , 分别)。 24 小时温育结束后,将细胞与 CYP3A4 底物(荧光素-IPA)在 37°C 下温育 3 小时。与酶活性成正比的发光信号用酶标仪测量,然后标准化为对照。指定对照来评估 AuNP 与母体底物或代谢物和无细胞底物的相互作用。 CYP活性以相对于对照组细胞的百分比表示。
基因表达分析
由于毒性 40 nm PEG-AuNP 用于抑制 C3A 细胞中的 CYP3A4 活性和抗氧化活性,显示出高细胞摄取,因此选择它来表征其毒性和不同细胞反应背后的分子作用机制。细胞以2.5 × 10 6 接种 6 孔板的每孔细胞,并在 37°C 下用 40 nm PEG-AuNP 的 LC50 值给药 24 小时。在孵育结束时,细胞进行 RNA 分离,然后使用平均 RNA 完整性数 (RIN) 值为 7.8 的总 RNA 进行 cDNA 合成,如前所述 [7,8,9]。将得到的 cDNA 与 RT 2 混合 SYBR green master mix(Qiagen Inc., Valencia, CA),然后应用于人类分子毒理学通路查找器或人类药物转运蛋白 RT 2 Quantstudio™ 7 Flex(Applied BioSystem, Foster City, CA)中的 Profiler™ PCR 阵列。具有倍数变化<− 2和> 2和p的差异表达基因 <0.05 表示目标基因的下调和上调。验证 RT 2 PCR 阵列数据、九个选定基因的表达通过 cDNA 合成和随后的实时 PCR 进行评估。引物序列总结在附加文件 1:表 S1 中。所有 PCR 反应均一式三份进行。实时荧光定量 PCR 条件和定量的详细方案在附加文件 1 中给出。
统计分析
C3A 细胞中 AuNP 的中位数致死浓度 (LC50) 值是通过使用 GraphPad Prism 6 (La Jolla, CA) 将具有可变斜率的 Hill 方程拟合到观察数据(AuNP 浓度水平的输入和相应的细胞活力)来估计的描述 [7]。使用 SAS 9.4(SAS Institute,Cary,NC)进行单向方差分析(ANOVA),以评估 AuNP 对 C3A 细胞中 ROS/RNS 产生和细胞摄取的影响。如果显着,则在 p 处使用 Tukey 诚实显着差异 (HSD) 检验进行多重比较 <0.05.
结果与讨论
裸血浆和人血浆 PC AuNP 的物理化学表征
纳米粒子尺寸、表面电荷和围绕 AuNP 的人体等离子体 PC 形成对流体动力学直径 (DH)、多分散指数 (PDI)、z 电位和光谱特性以及形态的影响已使用 DLS、TEM、和 UV-Vis 光谱(图 1)。在 TEM 图像中,去离子水中的所有裸(无 PC)AuNP 都是单分散的,具有紧密的尺寸分布和 521-553 nm 的独特 UV-Vis 光谱范围(图 1a)。随着尺寸分布的变化和吸收光谱的红移,观察到 AuNP 周围的 PC 形成(图 1b)。 D 除了 40 和 80 纳米 PC BPEI-AuNP 显示 PDI 值降低(0.29 和 0.32,分别)在 37°C 下 24 小时与 37°C 下 0 小时(分别为 0.62 和 1.0)(表 1)。与 37°C 下 0 小时时的 Z 电位值相比,所有裸金和 PC AuNP 的 Z 电位值在 37°C 下 24 小时相对下降。观察到 40 和 80 nm PC BPEI-AuNP 在 PBS 和完整 EMEM 中的聚集,这与尺寸分布中的多个峰和 DH 变化以及吸收光谱相对于裸 BPEI-AuNP 的红移相关(图 1 和其他文件 1:图 S1,表 1)。最近的研究支持这些结果,即 40 和 80 nm PC 和人血清白蛋白电晕包被的 BPEI-AuNP 在 PBS 和各种细胞培养基中聚集 [7,8,9]。
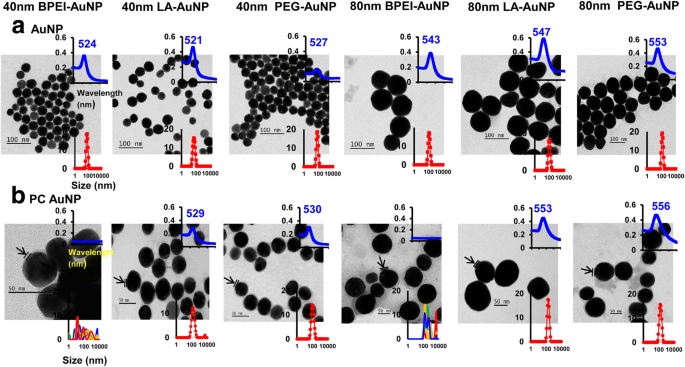
a 的透射电子显微照片 去离子水和b中的AuNP PC AuNP 在 PBS 中 0 小时、25°C、UV-Vis 光谱波长(上部插图)和动态光散射分布(下部插图)。箭头表示 PC 形成。 电脑 人血浆蛋白冠,BPEI 支化聚乙烯亚胺,LA 硫辛酸,PEG 聚乙二醇
<图>AuNP 细胞毒性
使用 C3A 细胞中的中值致死浓度 (LC50) 测量 AuNP 细胞毒性。图 2 显示了使用 AuNP 进行的 NP 依赖性 LC50 分析周围的 NP 表面电荷、粒径和 PC 形成。所有 40 nm BPEI-、LA 和 PEG-AuNP 以及 80 nm BPEI-AuNP 对C3A 细胞具有相应的 LC50 范围从 127.3 到 205.5 μg/cm 2 (图2a)。 80 nm 裸 PEG-AuNP 在最高浓度 250 μg/cm 2 下表现出 59% 的细胞活力 ,而 80 nm LA-AuNP 没有细胞毒性。除了 80 nm BPEI-AuNP 在 250 μg/cm 2 下显示 51% 的细胞活力外,PC 降低了 AuNP 毒性,因为它是尺寸和表面电荷修饰的函数 在 24 小时(图 2b)。最近的研究表明,40 nm 裸 BPEI-AuNP 对原代人肝细胞、HUVEC 和人肾近端小管细胞 (HPTC) 具有毒性(LC50 范围为 22.4–80.3 μg/cm 2 ) [7,8,9]。 PC 包覆的 BPEI-AuNP 对人肝细胞具有细胞毒性,但 HSA 包覆的 AuNP 没有细胞毒性 [7]。这些结果表明,由于癌细胞系的高增殖率和代谢活性,C3A细胞比原代人细胞对AuNP毒性更具抵抗力[31]。
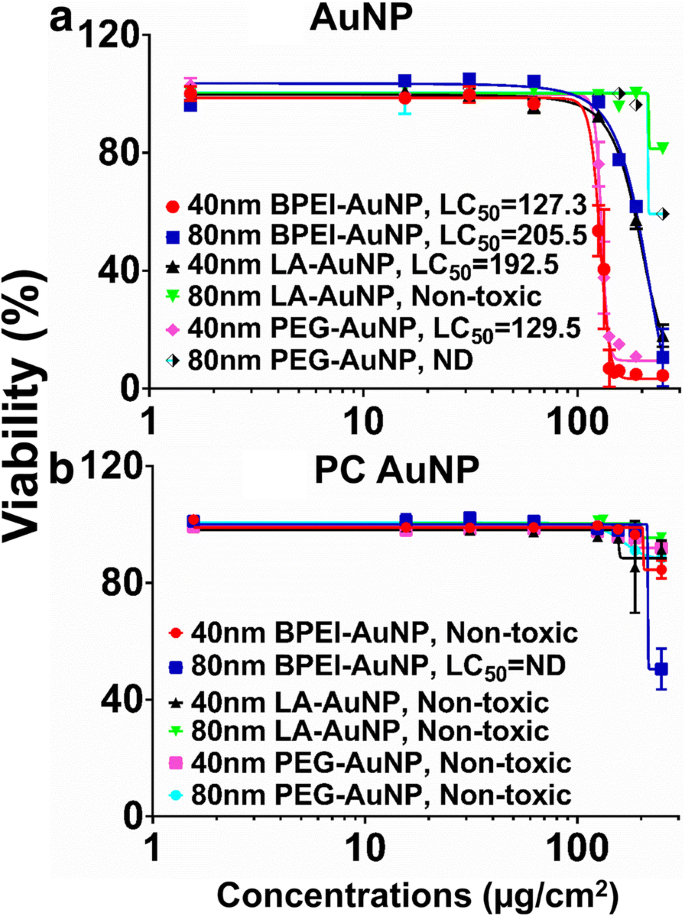
40 和 80 nm a 的 C3A 活力和 LC50 值 AuNP和b PC AuNP。数据代表平均值 ± 标准偏差。 (n =3)。 PC人血浆蛋白冠,ND未测定,BPEI支化聚乙烯亚胺,LA硫辛酸,PEG聚乙二醇,LC50半数致死浓度
AuNP 的细胞内摄取
在 1.56 μg/cm 2 下测定了所有裸金纳米粒子和 PC AuNP 的 NP 尺寸、表面电荷和 PC 依赖性细胞摄取 长达 24 小时。 ANOVA 显示随大小、PC 和时间的显着变化 (p <0.0001),以及交互作用(PC × 大小、PC × 时间、大小 × 时间和 PC × 大小 × 时间)(p <0.001) 对于所有 AuNP 吸收,除了 LA- 和 PEG-AuNP 吸收的微不足道的相互作用(PC × 大小)(p =0.2)。如图 3a-f 所示,除了 40 nm 裸露和 PC BPEI-AuNP 在 6 小时达到最高细胞摄取并随后下降之外,还观察到 40 nm 和 80 nm 裸露和 PC AuNP 的细胞摄取线性增加(图 3a)。然而,在 24 小时时,40 nm 阳离子 BPEI-AuNP 的摄取量最高,其次是中性 40 nm PEG-AuNP,然后是阴离子 40 nm LA-AuNP,这与 AuNP 的 C3A 细胞毒性顺序有关(图 2a) )。这一结果与之前的研究一致,即阳离子聚(N-(2-氨基乙基)丙烯酰胺)和 BPEI-AuNP 与阴离子聚(丙烯酸)-和 LA-AuNP 以及中性聚( N-(2,3-二羟丙基)丙烯酰胺-和 PEG-AuNP 在人结直肠腺癌 Caco-2 细胞、HPTC 和人肝细胞中 [9, 32]。此外,NP-PC 复合物减弱了所有 40 和 80 nm BPEI-和 LA-AuNP 以及 C3A 细胞中 40 nm PEG-AuNP 但加速了 80 nm PEG-AuNP 吸收(图 3f)。这些结果得到了最近研究的支持,即 PC 抑制了 HUVEC、HEK 和 HPTC 中的 AuNP 吸收,与大小和表面电荷无关 [8, 9, 33]。相比之下,PC 和 HSA 电晕增强了人肝细胞中 40 nm PEG-AuNP 的摄取,但后者诱导了 HEK 中 80 nm PEG-AuNP 的摄取 [7, 33] .
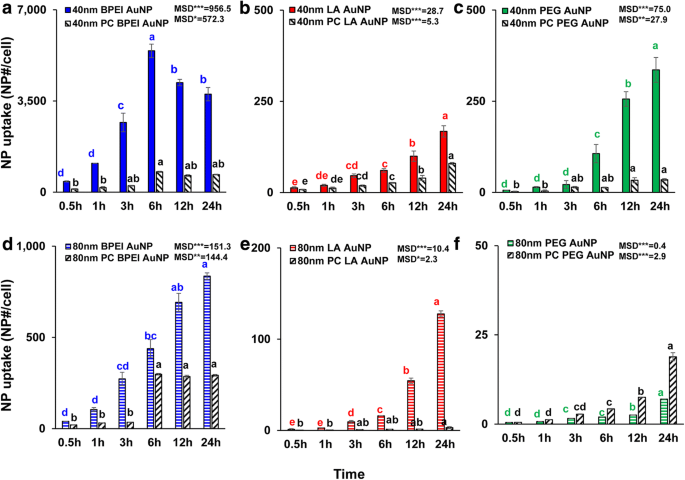
40 nm a 的时间依赖性细胞摄取 BPEI-AuNP,b LA-AuNP 和 c PEG-AuNP 和 80 nm d BPEI-AuNP,e LA-AuNP 和 f PEG-AuNP 在 C3A 细胞中不存在和存在 PC 时长达 24 小时。数据代表平均值 ± 标准偏差。 (n =3)。根据 Tukey 的 HSD 测试,字母有显着差异。 BPEI 支化聚乙烯亚胺,LA 硫辛酸,PEG 聚乙二醇,PC 人血浆蛋白冠,MSD 最小显着差异。 *p <0.05; ** p <0.005; ***p <0.0001
氧化和亚硝化压力测量
由于与其他 AuNP 相比,40 nm 裸 BPEI 和 PEG-AuNP 在 C3A 细胞中表现出更高的细胞毒性和细胞摄取,因此选择它们来研究 AuNP 诱导的氧化/亚硝化应激。 AuNP 均以时间和浓度依赖性方式调节 C3A 细胞中 ROS/RNS 的生成 (p <0.0001)和相互作用(时间×浓度,p <0.0001)。如图 4a 所示,在 40 nm BPEI-AuNP (62.5 μg/cm 2 和 125 μg/cm 2 ) 在 37°C 下 1 小时,但随后增加到 24 小时。相比之下,40 nm PEG-AuNP 在 39.1 μg/cm 2 时显着抑制了 ROS/RNS 的生成 直到 24 小时,倍数变化 <0.5(图 4b)。细胞死亡的激活通常会导致 NP 毒性,并且在大多数情况下,导致氧化应激的 ROS/RNS 产量增加是导致 NP 毒性的原因 [34]。使用 40 nm 阳离子 BPEI 和中性 PEG-AuNP 观察到表面电荷依赖性 ROS/RNS 产生。 40 nm BPEI-AuNP 在高浓度下显示出 ROS/RNS 生成的双相模式(1 小时抗氧化,3 小时后促氧化),这与其在 C3A 细胞中的细胞毒性有关(图 2a)。该结果与之前的研究一致,即 40 和 80 nm BPEI-AuNP 和 20 nm 柠檬酸盐-AuNP 诱导的 ROS 生成分别与它们在人肝细胞和 HepG2 细胞中的细胞毒性相关,且呈时间和浓度依赖性[7, 35]。 AuNP 在人早幼粒细胞白血病细胞 HL-60 中显示出氧化应激诱导的细胞毒性,总谷胱甘肽减少,无论大小[19]。相比之下,40 nm PEG-AuNP 作为抗氧化剂表明氧化/亚硝化应激可能不是 40 nm PEG-AuNP 诱导 C3A 细胞细胞毒性的直接机制(图 2b)。
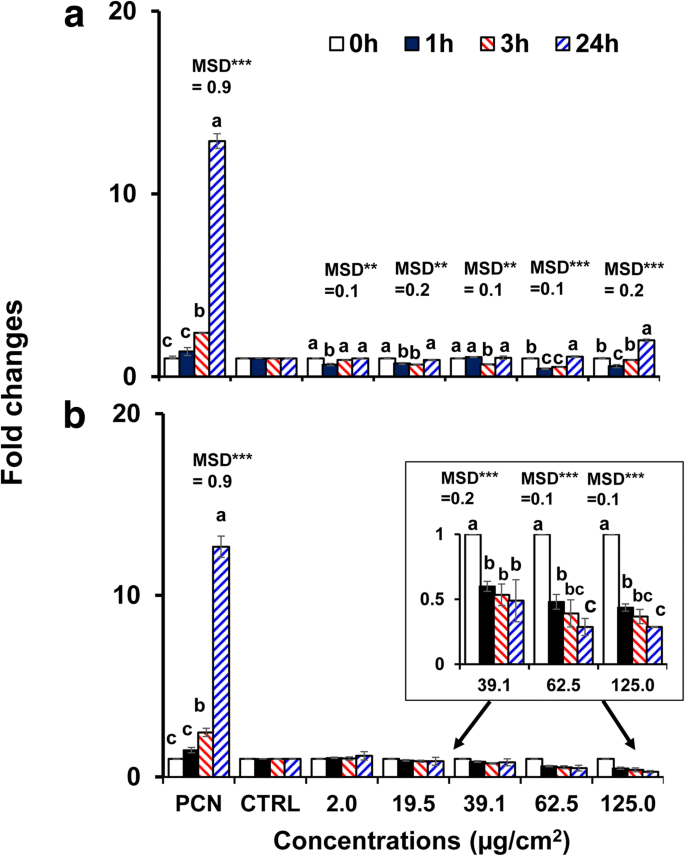
暴露于a的C3A细胞中的时间和浓度依赖性ROS/RNS产生 40 nm BPEI-AuNP 和 b 40 nm PEG-AuNP 长达 24 小时。数据代表平均值 ± 标准偏差。 (n =3)。根据 Tukey 的 HSD 测试,字母有显着差异。 BPEI 支化聚乙烯亚胺,LA 硫辛酸,PEG 聚乙二醇,CTRL 控制,MSD 最小显着差异,PCN 绿脓素(ROS 诱导剂)。 ** p <0.005; ***p <0.0001
CYP3A4 活动测量
表征了 40 和 80 nm 裸露和 PC AuNP 对 CYP3A4 活性的抑制作用。如图 5 所示,LC50 值下的 40 nm BPEI-、LA-和 PEG-AuNP 以及 80 nm BPEI-AuNP 抑制了 C3A 细胞中 CYP3A4 的催化活性,相应的活性为 20.1% 至 31.4%。控制,无论大小和表面电荷。 80 nm LA-和 PEG-AuNP 的无毒浓度也抑制了其活性(分别为 31.4% 和 26.6%)。然而,除了 40 和 80 nm PEG-AuNP 与对照相比显示 63% 和 46% 的活性之外,PC 还广泛改善了 40 和 80 nm AuNP 诱导的 CYP3A4 抑制。这与对人肝组织和肝细胞进行的体外研究一致,即阴离子单宁酸-AuNP 和阳离子 40 和 80 nm BPEI-AuNP 显着抑制 CYP3A4 的催化活性 [7, 25]。相比之下,阳离子 PEI-AuNP 和中性聚乙烯吡咯烷酮-AuNP 分别诱导 HepG2 细胞中 CYP1A2、CYP2C9 和 CYP3A4 以及大鼠肝切片中 CYP2B 和 CYP3A 的 mRNA 表达 [36, 37]。最近的研究表明,40 和 80 nm 裸露和 PC BPEI-AuNP 通过蛋白质构象变化或作为可逆抑制作用阻断底物口袋,显着抑制人肝细胞中的 CYP3A4 活性 [7]。
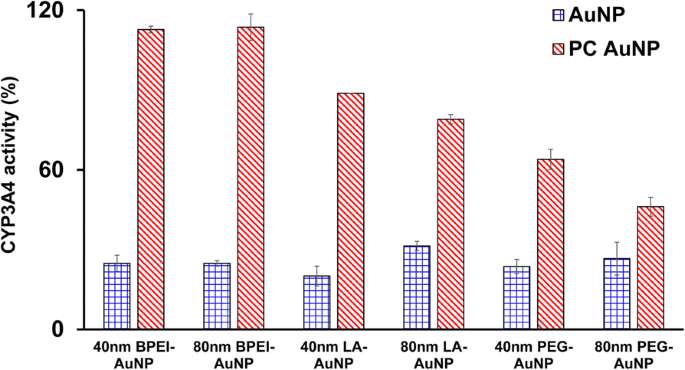
AuNP 对暴露于 40 和 80 nm BPEI-、LA-和 PEG-AuNP 在 PC 不存在和存在下 24 小时的 C3A 细胞中 CYP3A4 活性的抑制作用。数值代表平均值 ± 标准偏差。 (n =3)。 BPEI 支化聚乙烯亚胺,LA 硫辛酸,PEG 聚乙二醇,PC 人血浆蛋白冠
40 nm PEG-AuNP 的以毒性途径为中心的基因表达分析
从涵盖 13 种不同胁迫和毒性途径的代表性基因中,共有 212 个基因(↓186 和 ↑26 个基因)在 40 nm PEG-AuNP 的 LC50 值处差异表达(图 6,附加文件 1:表 S2– S7)。总基因(212个基因)的12.3%(26个基因,↓26,↑0个基因)主要参与线粒体脂肪酸β-氧化;细胞凋亡 11.3%(24 个基因,↓18,↑6 个基因); DNA损伤修复通路11.3%(24个基因,↓18,↑6个基因);热休克反应为 11.3%(24 个基因,↓22,↑2)。
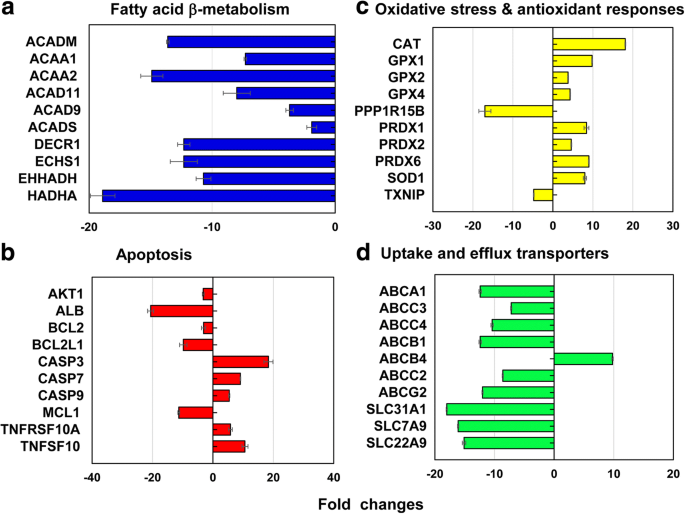
参与a的代表性基因 线粒体脂肪酸β-氧化,b 细胞凋亡,c 氧化应激和抗氧化反应,以及 d LC50 值为 40 nm PEG-AuNP 时的肝脏摄取和流出转运蛋白。所有数据在 p 处都有 <− 2 和> 2 的倍数变化 <0.05。基因本体分析列于附加文件1:表S2-S7
在线粒体脂肪酸β-氧化途径中,编码参与酰基辅酶A产生和减少NADH和FADH2当量的三种不同酶的基因主要受到抑制;酰基辅酶A脱氢酶中的ACAD11、ACAD9、ACADM和ACADS基因(2.0至13.6倍);酮酰基辅酶A硫解酶中的ACAA1和ACAA2(7.3至14.9倍); DECR1、ECHS1、EHHADH 和 HADHA(10.7 至 18.9 倍)在烯酰辅酶 A 水合酶中(图 6a,附加文件 1:表 S2)。线粒体脂肪酸 β-氧化在酰基辅酶 A 的产生和减少 NADH 和 FADH2 的当量中起重要作用,这与四种主要酶(酰基辅酶 A 脱氢酶、烯酰辅酶 A 水合酶、羟酰基辅酶 A 脱氢酶和酮酰辅酶 A 脱氢酶)有关。 -CoA 硫解酶 [38, 39]。此外,电子载体 NADH 和 FADH2 参与三羧酸 (TCA) 循环和线粒体呼吸链,导致 ATP 产生。在目前的研究中,40 nm PEG 诱导线粒体功能障碍,通过细胞内 ATP 和 FADH2 水平降低导致 ATP 维持的丧失,从而确定其在 C3 细胞中的细胞毒性(图 2a)。在暴露于 40 nm BPEI-的人肝细胞、HUVEC 和 HPTC 中也报道了类似的现象。 AuNP 表明线粒体功能障碍可能是 AuNP 毒性的常见机制,无论表面电荷和细胞类型如何 [7,8,9]。最近的一项研究报道,线粒体功能障碍相关的细胞毒性 w如在永生化前列腺癌上皮细胞和肺癌上皮细胞中观察到的对 STAT3 磷酸化抑制剂 OPB-51602 的反应 [40]。
在细胞凋亡通路中,CASP3、CASP7、CASP9、TNFRSF10A、TNFRSF10B和TNFSF10的6个促凋亡基因上调,而AKT1、ALB、BCL2、BCL2L1、MCL1和XIAP的6个抗凋亡基因下调(图3)。 . 6b,附加文件 1:表 S3),它与 C3A 细胞中的剂量依赖性细胞毒性相关(图 2a)。在 DNA 损伤和修复检查点,检查点激酶 (CHEK1/2)、DNA 切除修复基因 (ERCC1/2/3) 和 DNA 连接酶 IV (LIG4) 的基因上调,但其他切除修复基因 (ERCC5/ 6、XRCC1/5)、检查点激酶 (CDKN1A) 和蛋白激酶 (PRKDC) 基因被下调(2 至 19 倍)。这些结果表明 40 nm PEG-AuNP 诱导的对细胞周期和 DNA 修复系统的干扰可能与 C3A 细胞中细胞死亡的诱导相关(图 2a,附加文件 1:表 S3)。编码两种不同热休克蛋白 (HSP)(A1A 和 A1B)的基因被上调(10.2 至 14.2 倍),但 HSP40 亚家族 A、B 和 C; HSP90会员1名;和 HSP60 下调(2 至 16 倍)(附加文件 1:表 S4)。
在氧化应激和抗氧化反应中,LC50 值的 40 nm PEG-AuNP 诱导抗氧化剂基因并抑制促氧化剂,这与作为抗氧化剂本身的 ROS/RNS 生成减少有关(图 4b)。在抗氧化基因中,谷胱甘肽过氧化物酶 (GPX) 1、GPX2、GPX4、PRDX1、PRDX2、PRDX6、超氧化物歧化酶 (SOD) 1 和 CAT 被诱导(3.8 至 18.1 倍)。在促氧化基因中,TXNIP 和 PPP1R15B 被抑制(分别为 4.8 倍和 17 倍)(图 6c,附加文件 1:表 S5)。这与之前的研究一致,即金纳米粒子在 HepG2 和人类肝细胞中表现出氧化应激诱导的细胞毒性,无论大小[7, 19]。
在 I 期代谢中,CYP3A4 和 ESD 基因被广泛抑制(分别为 7 倍和 12 倍)。特别是,40 nm PEG-AuNP 对 CYP3A4 表达的抑制作用与 CYP3A4 活性的降低相关(图 5)。最近的研究报告说,40 nm BPEI-AuNP 抑制了人肝细胞中 CYP1A2、CYP2C9 和 CYP3A4 的基因表达; HUVEC 中的 ESD; HPC 中的 CYP1A1 [7,8,9]。流行病学研究表明,肝癌患者肝组织中的CYP酶在分子和功能水平上受到致瘤过程的显着抑制[41]。
药物摄取和外排转运蛋白基因表达分析
肿瘤细胞产生的多药耐药性 (MDR) 是癌症治疗失败的主要原因之一 [42, 43]。整合膜转运蛋白介导的药物摄取减少和药物外流增加,包括P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)是MDR的主要机制之一。
暴露于 40 nm PEG-AuNP 的 C3A 细胞中药物外排和摄取转运蛋白的差异基因表达显示,ABC 转运蛋白共有 14 个基因(↓12 和 ↑2 个基因)和 SLC 转运蛋白共有 21 个基因(↓21 和↑0 基因)在 LC50 值处受到显着调节(图 6d 和 7,附加文件 1:表 S7)。在ABC家族的药物外排转运蛋白中,基底外侧膜多药耐药相关蛋白(MRP3/ABCC3)、MRP4(ABCC4)和胆固醇外排调节蛋白(CERP/ABCA1)基因下调(7.2至10.4倍)。小管外排转运蛋白中编码 P-gp (ABCB1)、MRP2 (ABCC2)、BCRP (ABCG2) 和甾醇 2 (ABCG8) 的基因也受到抑制(8.6 至 13.8 倍)。相比之下,小管膜中的多药耐药性(MDR4/ABCB4)和线粒体外膜中的线粒体 ABC 转运蛋白(MTABC3/ABCB6)被高度上调(分别为 9.8 倍和 5.8 倍)。在药物摄取转运蛋白中,铜转运蛋白基因 (CTR1/SLC31A1) 和有机阴离子转运基因 (OAT7/SLC22A9) 也受到较小程度的抑制(分别为 18 倍和 15 倍)。这些结果支持最近的一项研究,即 40 nm BPEI-AuNP 下调人肝细胞中的 MDR3,但上调 HUVEC 中的 MRP3,表明 AuNP 和外排转运蛋白之间的表面电荷和细胞类型依赖性相互作用 [7, 8]。流行病学研究表明,HCC 肿瘤中 BCRP 高表达,OCT3 低表达,这与肿瘤的进展和大小密切相关 [44]。先前的一项研究表明,P-gp 抑制剂维拉帕米通过增加细胞内药物浓度来增强与阿霉素结合的谷胱甘肽-AuNP 在猫纤维肉瘤细胞系中的细胞毒性 [45]。目前的研究强调,40 nm PEG-AuNP 的机制衍生信息确定了对线粒体脂肪酸 β-氧化、TCA 循环和呼吸链、药物流出和摄取转运蛋白以及 CYP3A4 活性的独立但仍然互补的作用。 C3A 细胞(图 7)。最后,这将突出AuNP与HCC中关键生物学过程的相互作用及其潜在的分子机制,这可能进一步涉及开发更有效的HCC治疗靶点。
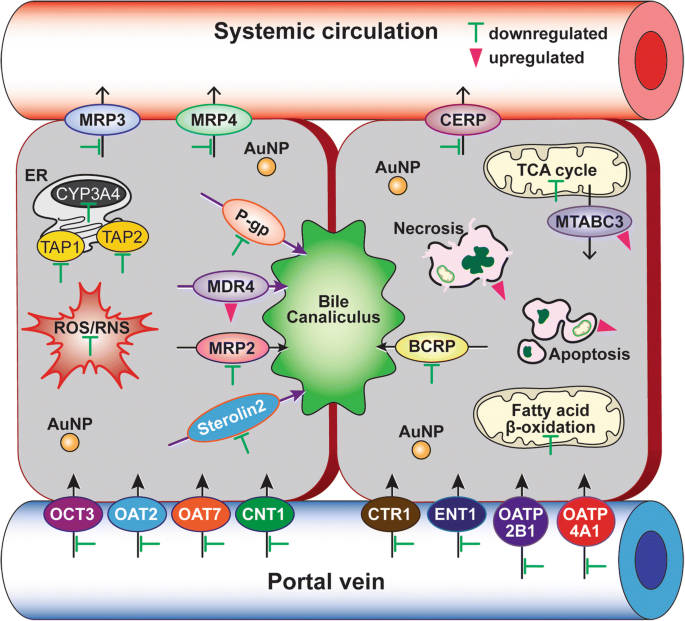
40 nm PEG-AuNP 在 HCC 治疗中的基本作用机制示意图。绿色条(抑制)和粉红色三角形(诱导)表示 40 nm PEG-AuNP 修饰的生物标志物和途径。基因本体分析列于附加文件1:表S2-S7
从 RT 2 验证基因表达分析 阵列,选择九个基因进行实时PCR。在附加文件 1:表 S1 中,所有九个基因都在 40 nm PEG-AuNP 的 LC50 下进行了调节。这些转录变化与 PCR 阵列的基因表达分析一致(图 6,附加文件 1:表 S2-S7)。
结论
我们已经提出阳离子 BPEI-、阴离子 LA- 或中性 PEG-AuNP 与人血浆蛋白冠 (PC) 的相互作用导致 D AuNP 的 H、PDI 和 z 电位并进一步影响 C3A 细胞中的细胞反应。除了 80 nm LA-AuNP 之外,所有裸(无 PC)40 和 80 nm AuNP 对 C3A 细胞都具有细胞毒性,但除了 80 nm BPEI-AuNP 外,PC 完全改善了它们的细胞毒性。 40 nm 裸 BPEI-AuNP 显示出最高的细胞吸收,其次是 40 nm PEG-AuNP,然后是 40 nm LA-AuNP,而 PC 抑制了除了 80 nm PEG-AuNP 之外的 AuNP 吸收。 40 nm BPEI-AuNP 在 C3A 细胞中引起氧化应激(前体和抗氧化剂)的双相反应,而 40 nm PEG-AuNP 是抗氧化剂。 CYP3A4 活性被所有裸 AuNP 广泛抑制,无论大小和表面电荷如何,而 PC 显着改善了其对酶活性的抑制作用,除了 40 和 80 nm PEG-AuNP。 LC50 值为 40 nm PEG-AuNP 的差异表达基因主要参与线粒体脂肪酸 β-氧化,并在较小程度上参与肝外排/摄取转运蛋白。 40 nm PEG-AuNP 抑制 β-氧化中的三种主要酶(酰基-CoA 脱氢酶、烯酰-CoA 水合酶和酮酰基-CoA 硫解酶)、TCA 循环中的其他酶以及用于 ATP 产生的线粒体呼吸链。 40 nm PEG-AuNP 在 LC50 值下增加了促凋亡基因的表达并减少了抗凋亡基因。在暴露于 40 nm PEG-AuNP 的 C3A 细胞中观察到高水平的抗氧化剂和低水平的促氧化剂基因。此外,位于基底外侧膜和小管膜的药物外排和摄取转运蛋白基因均受到显着调节。
缩写
- 方差分析:
-
单因素方差分析
- AuNP:
-
金纳米粒子裸露:无PC
- BPEI:
-
支化聚乙烯亚胺
- CYP:
-
细胞色素 P450
- D :
-
流体动力学直径
- DLS:
-
动态光散射
- EDTA:
-
乙二胺四乙酸
- EMEM:
-
鹰的最低必需培养基
- HCC:
-
人肝细胞癌
- HPTC:
-
人肾近端肾小管细胞
- HSD:
-
Tukey 诚实显着差异检验
- HUVEC:
-
人脐静脉细胞
- ICP-MS:
-
电感耦合等离子体质谱
- 洛杉矶:
-
阴离子硫辛酸
- LC50:
-
半数致死浓度
- MDR:
-
多重耐药性
- NP:
-
纳米粒子
- PBS:
-
磷酸盐缓冲盐水
- PC:
-
人血浆蛋白冠
- PDI:
-
多分散指数
- PEG:
-
中性聚乙二醇
- RNAi:
-
RNA干扰
- RNS:
-
活性氮种类
- ROS:
-
活性氧
- SO:
-
超氧化物
- TEM:
-
透射电子显微镜
- TFF:
-
切向流过滤
纳米材料
- 酒店维护及其对您的底线的影响
- 基于局部表面等离子体共振的金纳米生物传感器能够诊断人类布鲁氏菌病,介绍一种快速且经济的方法
- 一维混合二元氧化物 CeO2-LaO x 支持的金催化剂的合成和 CO 氧化活性
- 聚(3,4-亚乙基二氧噻吩)/金/石墨烯复合材料的固态加热合成及其在安培法测定亚硝酸盐和碘酸盐中的应用
- 用 6-巯基嘌呤和神经元穿透肽修饰的金纳米颗粒促进 SH-SY5Y 细胞生长
- 磁性金纳米粒子标记乙酰肝素酶单克隆抗体及其在肿瘤磁共振成像中的后续应用
- C60 富勒烯对二苯基-N-(三氯乙酰基)-氨基磷酸酯在硅胶中与 DNA 相互作用的影响及其对体外人白血病细胞系的细胞毒活性
- PEG-PCCL 纳米颗粒的毒性评估及其负载紫杉醇抗肿瘤作用的初步研究
- 碳纳米管及其衍生物对体外肿瘤细胞和生化参数、体内细胞血液成分的影响
- 评估金纳米颗粒抑制的细胞色素 P450 3A4 活性及其在人肝细胞癌细胞系 C3A 中的细胞毒性的分子机制
- 荧光新糖蛋白金纳米团簇:合成及在植物凝集素传感和细胞成像中的应用
- 毛蒿、马齿苋和夏枯草提取物的抗氧化潜力用于金纳米颗粒的生物制造和细胞毒性评估


