用 pH(低)插入肽 (pHLIP) 修饰纳米囊泡用于靶向递送
摘要
癌细胞表面的酸性是肿瘤微环境的标志,它不依赖于肿瘤灌注,因此它可以作为靶向肿瘤细胞的通用生物标志物。我们使用 pH(低)插入肽 (pHLIP) 来装饰脂质体和 niosome。 pHLIP 感应癌细胞表面的 pH 值并插入靶细胞的膜中,并将纳米材料带到细胞膜附近。 DMPC 脂质体和 Tween 20 或 Span 20 脂质体在其涂层中具有和不具有 pHLIP 的特性,以获得对纳米载体特征的基本了解,并促进对酸度敏感的纳米载体的合理设计。证明了样品随时间和在血清存在下的稳定性。研究了纳米载体的大小、ζ 电位和形态,以及它们捕获亲水探针和调节其释放的能力。 pHLIP修饰的囊泡可用于延长(修饰)生物活性物质的释放,以靶向肿瘤和其他酸性病变组织。
介绍
大约一个世纪前,保罗·埃利希 (Paul Ehrlich) 提出了实现“灵丹妙药”的想法,以实现特定和更有效的药物输送 [1]。 “灵丹妙药”应该能够保护递送的药物免受恶劣环境的影响,通过将药物靶向病变组织、改善药物的药代动力学和药效学以及调节药物释放来减少副作用[2]。
1965 年,Bangham 首次观察到基于磷脂的囊泡 [3],在接下来的几年里,Gregory Gregoriadis 确立了脂质体可以封装药物然后用作药物递送系统的概念。特别是,它们由磷脂封闭双层(薄片)组成,其中疏水性脂质链在两个亲水性头基层之间封闭。封闭的双层围绕着水核,因此可以分别定位亲脂性或亲水性药物[4, 5]。
在血浆蛋白吸收、网状内皮系统 (RES) 识别、循环半衰期和细胞运输方面,脂质体大小是影响给药后载体命运的关键参数。纳米载体有利于细胞内化和肿瘤靶向,因此许多研究人员一直关注“纳米化”[6,7,8,9]。
为了获得更通用和更经济的纳米载体,合成表面活性剂已被用于获得脂质体样药物递送系统。非离子表面活性剂被广泛用于此目的,并且能够自组装成单层或多层囊泡(非 -离子脂质体 、niosomes 或非离子表面活性剂囊泡)。山梨糖醇酯表面活性剂 (Spans®) 是广泛用于 niosome 制备的亲脂性物质。为了延长囊泡循环时间并获得“隐形”纳米载体,聚乙二醇 (PEG) 掺入是一种金标准方法:通过这种结合,获得乙氧基乙基化脱水山梨糖醇酯表面活性剂 (Tweens®)。 Span 和 Tween 都具有不同的亲水/亲油平衡 (HLB) 值,并且表面活性剂的选择允许制备具有所需特性的 niosome [10]。此外,胆固醇的添加用于通过拉伸表面活性剂尾部来增强双层稳定性,影响表面活性剂的凝胶到液相转变温度并赋予亲脂性双层的刚性 [11, 12]。“优化的”纳米载体被设计改进配方和/或增强靶向性 [10]。
如今,癌症是世界上主要的死亡原因之一。当前的治疗方法存在许多局限性,包括对肿瘤的药物递送效率不高,以及缺乏与不良和危险副作用相关的肿瘤靶向性,纳米技术方法可能有助于克服这些局限性 [13]。
目前,各种靶向方法正在开发中。它们中的大多数是基于靶向在癌细胞表面过度表达的特定生物标志物。然而,由于人类肿瘤非常异质,更通用的肿瘤靶向方法将更加有利。癌细胞表面的酸性是肿瘤微环境的标志,它不依赖于肿瘤灌注,因此它可以作为靶向肿瘤细胞的通用生物标志物[14]。 pH(低)插入肽 (pHLIP) 技术正在迅速发展,用于将成像和治疗小分子以及纳米材料靶向肿瘤。 pHLIP 检测癌细胞表面的 pH 值并插入靶细胞的膜中 [15, 16]。 pHLIP 的插入机制是由肽的带负电荷残基在低 pH 值(pH <7.0)下质子化触发的。这导致肽的疏水性增加,从而使平衡朝着将肽分配到双层中的方向移动 [17]。用 pHLIP 装饰的纳米载体具有生物相容性,可以靶向肿瘤,并证明癌细胞的细胞摄取增强。已研究的 pHLIP 包覆纳米颗粒包括脂质、聚合物和金属基纳米材料 [18,19,20,21]。
本工作的目的是充分表征由pHLIP修饰的新型囊泡纳米载体,以从根本上了解纳米载体的特征并促进酸敏感纳米载体的合理设计。
材料和方法
材料
聚氧乙烯脱水山梨糖醇单月桂酸酯 (Tween 20)、脱水山梨糖醇单月桂酸酯 (Span 20)、胆固醇 (Chol)、Hepes 盐 {N -(2-idroxyethyl) 哌嗪-N ′ -(2-乙磺酸)}、人血清、Sephadex G-75、钙黄绿素和二苯基己三烯 (DPH) 购自 Sigma-Aldrich。 1,2-二肉豆蔻酰基-sn -glycero-3-phosphocholine (DMPC) 和 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N -[4-(对马来酰亚胺苯基)丁酰胺]钠盐(DSPE-马来酰亚胺)购自Avanti Polar Lipids,芘购自Fluka。 pHLIP肽(ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGT)由CS Bio合成和纯化。其他产品及试剂均为分析纯。
DSPE-pHLIP 的合成
pHLIP 通过 DSPE-马来酰亚胺与 pHLIP N 末端的单个半胱氨酸残基共价结合,与甲醇中的 DSPE 脂质结合,如前所述 [18, 21, 22]。简而言之,将溶解在 250 μL 甲醇(用氩气吹气)中的 5 mg 肽和溶解在氯仿中的 DSPE-马来酰亚胺(来自 9.9 mM 储备溶液)以 1:1 的摩尔比混合。反应混合物在室温下保持约 2-6 小时,直到缀合完成。 DSPE-马来酰亚胺与 pHLIP 偶联的反应进程通过 RP-HPLC 使用 25% 至 80% 乙腈/含 0.05% TFA 的梯度通过监测对应于反应混合物中未标记 pHLIP 的峰的下降来监测。合成的构建体通过 SELDI-TOF 质谱法表征。使用 pHLIP 的摩尔消光系数通过吸光度确定 DSPE-pHLIP 偶联物的浓度:ε 280 =13,940 M −1 cm −1 .
囊泡制备和纯化
薄层蒸发法用于制备非离子表面活性剂(来自 Tween 20 或 Span 20)和磷脂(来自 DMPC)囊泡,有和没有 pHLIP。在每个囊泡制剂中,胆固醇以不同的摩尔比加入(表 1)[23]。
样品组成已被优化,选择先前已充分表征的结构 [24, 25],其中添加了相同数量的 pHLIP。
首先将亲脂性组分溶解在 CHCl3:CH3OH 混合物 (3:1) 中;然后根据样品在不同温度下在真空下除去有机溶剂。所得薄膜用 5 mL Hepes 缓冲液 (0.01 M pH 7.4) 或钙黄绿素钠溶液 10 -2 水合 M. 将悬浮液涡旋混合约 5 分钟,然后使用以 20 kHz 运行的微探针(VibraCell-VCX 400-Sonics,Taunton,MA,USA)进行超声处理(参见附加文件 1:表 S1,支持信息)。 LipoDMPC在惰性气氛下进行超声处理以防止氧化。
然后使用Sephadex G-75(50 × 1.2cm的玻璃柱)和Hepes缓冲液作为洗脱液通过凝胶渗透色谱法纯化囊泡悬液。纯化后的囊泡悬液用合适孔径的纤维素滤膜过滤。
用相同的制备方法制备了pHLIP包被的niosomes和脂质体。
动态光散射测量
在 T 测量囊泡的平均大小和大小分布 =25°C,通过动态光散射 (DLS),使用配备 5 mW HeNe 激光器(波长 λ =632.8 nm)和数字相关器的 Malvern NanoZetaSizer ZS90。通过Contin算法分析90°角散射强度的归一化自相关函数,得到粒子扩散系数分布D ,因此有效流体动力学半径的分布R 通过 Stokes-Einstein 关系的囊泡 H R H =K BT /6πηD , 其中 K BT 是热能,η 是溶剂粘度。 niosomes/脂质体的大小分布的宽度相当小但不可忽略。表 2 中报告的值对应于颗粒的强度加权平均流体动力学直径 [26]。
ζ-电位测量
使用 Malvern NanoZetaSizer ZS90 仪器,通过激光多普勒电泳技术进行电泳迁移率测量。流动性u 被转换成ζ -电位使用 Smoluchowski 关系 ζ =uη/є,其中 η 和 є 分别是溶剂相的粘度和介电常数 [27]。
小角度 X 射线散射
小角 X 射线散射 (SAXS) 实验在欧洲同步辐射装置(ESRF,格勒诺布尔,法国)进行。使用 ID02 高亮度光束线可以对动量传递 0.1 nm -1 区域的稀溶液进行测量 ≤ q ≤ 6 nm -1 , q =(4π/λ)sin(θ/2),其中 θ 是散射角,λ =0.1 nm 是 X 射线波长。相应的研究长度范围在 1 到 60 nm 之间,适用于访问 niosomal 和脂质体囊泡的内部结构。所有实验均在 T 进行 =25 °C,照射时间短,0.1 s,以防止辐射损伤。对于每个样品,在二维检测器上捕获不同散射角度的散射强度,然后进行角度重组,减去背景和溶剂的贡献,并进行分析以获得溶液中囊泡的形状和内部结构的信息。
在单层囊泡的情况下,封闭双层用三个同心壳建模,对应于外部头基、疏水链和内部头基。假设囊泡大小服从舒尔茨分布。
冷冻 TEM
将囊泡溶液(5 μL 液滴)铺在 Lacey formar/碳电子显微镜网格上,并通过在液态乙烷中快速冷冻以冷冻水合状态保存。玻璃化过程使用 FEI Vitrobot 系统进行,设置单印迹时间为 3 秒,偏移量为 1,排液和等待时间为 1 秒。透射电子显微镜 (TEM) (JEOL 2100) 加速电压为 200 kV,放大倍数为 × 10,000 至 × 150,000,用于对囊泡成像。
稳定性研究
使用和不使用 pHLIP 制备的 niosomes 和脂质体的物理稳定性研究在两种不同的储存温度(25 °C 和 4 °C)下进行。目的是评估在 90 天内囊泡分散的大小和 ζ 电位是否发生显着变化。以一定的时间间隔(1、30、60 和 90 天)抽取每批样品,并如前所述测定囊泡大小和 ζ 电位。
类似地,还在存在生物流体(例如人血清)的情况下研究了囊泡稳定性。在 37°C 下将悬浮液与 45% 的人血清接触。在确定的时间间隔(0、30 分钟、1 小时、2 小时和 3 小时),如所述确定囊泡大小和 ζ 电位的变化。
双层表征
通过分别位于双层膜疏水区域的两个荧光探针二苯基己三烯 (DPH) 和芘的荧光测量,获得了 niosomal 和脂质体双层的流动性和微粘度 - 极性。在制备囊泡之前,将 DPH (2 mM) 和芘 (4 mM)(分别为 220 μL 和 2.5 mg)添加到表面活性剂或磷脂/胆固醇混合物中 [28]。之后,如前文所述纯化装载芘的囊泡,而装载 DPH 的囊泡通过逐渐变小的孔径(从 5.0 到 0.22 μm)过滤。
在室温下使用 LS55 分光荧光计(PerkinElmer,MA,USA)在 λexc =400 nm 和 λem =425 nm 下进行荧光各向异性测量,荧光各向异性(A ) 样品的计算公式[29]:
$$ A=\frac{I_{vv}-{I}_{vh\kern0.5em }x\ G}{I_{vv}+2{I}_{vh}\ x\ G} $$其中我 vv 和我 vh 是发射荧光的强度(任意单位),分别平行和垂直于垂直偏振激发光的方向。修正系数G =I hv /我 哈 是激发光水平偏振时垂直和水平偏振发射分量之间的比率。荧光各向异性值与膜流动性成反比。因此,高荧光各向异性值对应于高结构有序和/或低膜流动性[30]。
为了评估囊泡双层的微粘度和微极性,使用 Perkin-Elmer LS55 荧光分光光度计在 λexc =330 nm 处进行芘荧光实验,记录范围 350 <λem <550 nm 的发射光谱 [28] .芘荧光的精细结构呈现五个峰。芘荧光光谱的第一(372 nm)和第三(382 nm)振动带的强度比,I 1/我 3,与芘环境的极性有关[31]。事实上,I 的低值 1/我 3 比率对应于非极性环境。此外,掺入囊泡双层中的芘分子可能形成分子内准分子,这个过程对探针微环境的粘度敏感 [32]。因此,准分子/单体的荧光强度比,I E/我 M,与微粘度有关。
对有和没有pHLIP制备的囊泡进行了这些研究,然后比较了所得结果。
钙黄绿素释放研究
非离子表面活性剂或磷脂囊泡负载钙黄绿素浓度为 10 -2 M. 在这个浓度下,钙黄绿素荧光会自熄 [33]。然后使用去猝灭测量来确定钙黄绿素从囊泡水性核心中的释放。通过添加 5 mL 钙黄绿素水溶液,在薄膜水合过程中将荧光探针加载到囊泡中。囊泡悬液通过凝胶渗透色谱法纯化,与 45% 的人血清或 Hepes 接触,然后装入纤维素膜透析袋(截断分子量 8.000 Da,来自 Spectra/Por®)。释放实验在 37 °C 下进行,在 Hepes 缓冲液(10 mM,pH 7.4)作为外部介质的磁力搅拌下进行。在 0-24 小时内的不同时间取出等分的外部培养基。不时将取出的等分试样重新引入系统[34]。
钙黄绿素释放通过使用Perkin-Elmer LS50B分光荧光计测量培养基的荧光来监测,λex =492和λem =520nm。参考值F ∞(任意单位),与包埋在囊泡中的钙黄绿素总量相关 [35],是在使用异丙醇 (1:1 v /v )。释放百分比 (F %) 在每个时间点使用以下公式获得:
$$ F\%={F}_t/{F}_{\infty }x\ 100 $$其中 F t(任意单位)是特定时间点t的荧光读数 .
统计分析
单向方差分析用于统计分析。后验 Bonferroni t 进行检验以评估方差分析检验的统计显着性。一个 p 值 <0.05 被认为具有统计学意义。结果为三个实验的平均值± 标准偏差。
结果与讨论
使用和不使用 DSPE-pHLIP 制备的 Tween20-、Span20- 和 DMPC-囊泡的大小和 ζ 电位(表 2)。
根据表 2 中显示的结果,无论是否存在 pHLIP,所分析的样品在尺寸或 ζ 电位方面均未显示显着变化。
上述报道的尺寸范围是通过不同的分析技术证实的,例如冷冻透射电镜(图 1)。
<图片>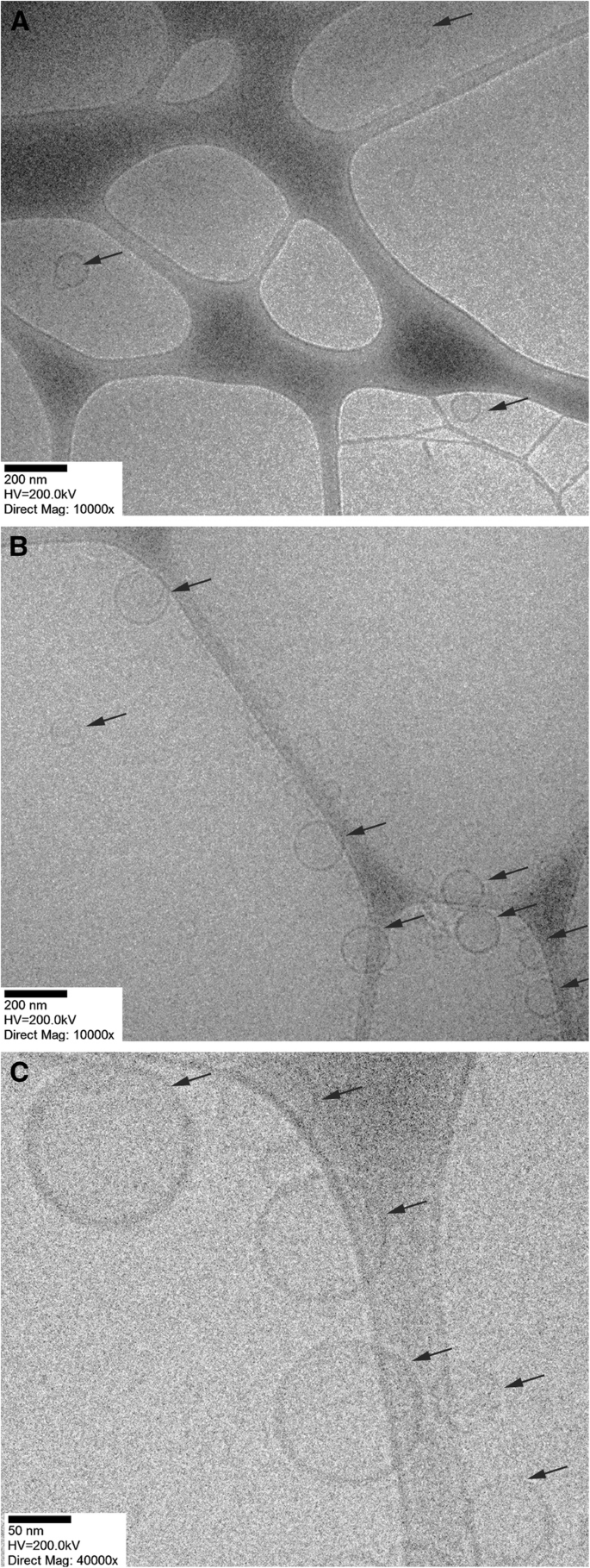
用 pHLIP 包被的 niosomes 和脂质体的代表性冷冻 TEM 图像。 NioSpan20-pHLIP niosomes (a ) 和 LipoDMPC-pHLIP 脂质体 (b ) 在 × 10,000 倍放大率和 LipoDMPC-pHLIP 脂质体 (c ) 在 × 40,000 放大倍数下获得
通过 SAXS 实验确定有和没有 DSPE-pHLIP 的 niosomes/囊泡的内部结构。图 2 中的 SAXS 强度光谱不同,表明每个系统都有其独特的特征。
<图片>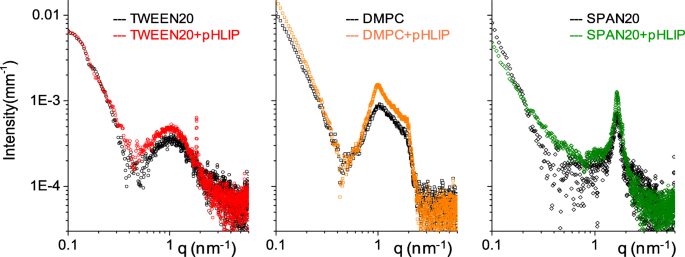
SAXS 光谱。无(黑色空心符号)和有 DSPE-pHLIP(彩色符号)的 niosomes/囊泡的强度谱
基于 Tween20 的 niosomes 是单层的,而 DMPC 囊泡显示出一定程度的多层(作为脂质体),如 q 处特征峰的存在所示 ≅ 1 nm −1 ,对应于 6 nm 的层间距离(约 5 nm 脂质双层和 1 nm 水)。基于 Span20 的囊泡肯定是多层的,在 q 处具有特征峰 =1.6 nm −1 对应于 3.8 nm 的层间距离,匹配 Span20 分子长度的两倍。结果表明,Span20囊泡的多层壳由相邻的双层组成,几乎没有层间水。
DSPE-pHLIP 的存在(小于 1% 摩尔分数)不会显着影响系统。所有被调查的q的散射强度 -范围非常相似,表明结构材料的比例相当,囊泡颗粒的总体尺寸相当。
基于 DMPC 的囊泡显示脂质体内双层的数量略有增加,这可以通过 q 处布拉格峰的强度增加来推断 =1 nm −1 .与每个肽分子连接的少量 DSPE C18 链的插入不会改变脂质双层的厚度,并且主要由相对于 DMPC 的大部分胆固醇(约 40-50%)决定。在该胆固醇浓度下,脂质链被组织在液体有序 (Lo) 相中,其特征在于链的弱横向位置顺序与沿链的高取向顺序解耦,并且能够承载少量 C18-链没有任何结构变化[36]。基于 Span20 的多层囊泡的内部结构也没有变化。
在 Tween20 + pHLIP 系统中,存在少量胆固醇微晶,如 q 处的典型尖峰所示 =1.84 nm −1 (特征距离为 3.41 nm),囊泡结构不受影响。经常发现少量微晶的存在与基于吐温的 niosomes [37] 相关,其数量取决于组成、制备程序和纯化。在图 2 中,Tween20 和 Tween20 + pHLIP 囊泡的两个实验光谱与通过模拟具有三个同心壳的球形闭合双层获得的拟合曲线一起显示:外部头基、链和内部头基。两个系统中囊泡的拟合平均大小约为 168 nm,与 DLS 结果一致。两个闭合双层的结构参数相同(参见附加文件 1:图 S1 和表 S2),除了外壳:在 DSPE-pHLIP 存在下,头部基团的电子密度略有下降(5%)观察到(从 0.42 到 0.40 e/Å 3 ),同时增加层的粗糙度。该结果表明添加 DSPE-pHLIP 主要影响囊泡的外壳。这与 DSPE C18 链插入双层并将肽锚定到囊泡表面的图片一致,在扩展和分枝的聚乙二醇头部基团中。我们注意到,在不饱和磷脂双层的情况下,SAXS 最近观察到 pHLIP 肽本身(不与脂质分子连接)在高 pH 值下与囊泡的外表面相互作用并在低 pH 值下插入双层的能力 [38 ]。在本研究中,肽的摩尔分数显着降低,并且肽与脂质相连,因为目标是设计 pHLIP 包被的 pH 敏感药物纳米载体。 pHLIP 结合是由插入纳米载体疏水区域的共轭 DSPE C18 链的疏水相互作用驱动的。 pHLIP 肽被锚定并位于外部头基区,在酸性 pH 下易于与靶膜相互作用和/或在低 pH 环境下双层重排后释放纳米载体内容。
为了研究 pHLIP 的存在是否会影响双层微流变特性(流动性、微粘度和极性),进行了亲脂壳表征。表征研究是通过使用荧光探针芘进行的,在制备过程开始时添加到样品中。由于其亲脂性,它插入囊泡双层并提供有关膜环境极性和微粘度的信息。
如表 3 所示,在所有三个样品组中,与没有 pHLIP 的对应囊泡相比,存在 pHLIP 时的极性值略有下降,而所有囊泡的微粘度值均增加了三倍。
双层通过测量另一种亲脂性荧光探针 DPH 的荧光各向异性进一步表征,并入脂质。这些测量反映了探针在双层内的运动及其方向,这提供了双层流动性的信息,这些信息可以影响囊泡释放其内容物的能力[29]。荧光各向异性值与膜流动性成反比。因此,高荧光各向异性值对应于高结构有序和/或低膜流动性,如液体有序相[30]。
每个样品的各向异性值显示在表 3 中。数据表明囊泡中 DSPE-pHLIP 的存在增加了膜流动性,因为荧光各向异性降低。众所周知,双层流动性不仅受非极性链的顺序和横向组织的影响,还受极性头部基团的影响 [31]。三种不同系统的 SAXS 结果表明 DSPE-pHLIP 分子主要影响头部基团区域,最终导致极性头部的不同堆积。结构结果似乎与双分子层在相关 DSPE-pHLIP 存在下的微流变特性相匹配,如插入两种不同探针所揭示的那样。结果显示如芘所揭示的微粘度增加,芘是一种可以插入靠近外部区域的探针(芘 log P 为 4.88)。另一方面,假设 DPH 嵌入双层的核心,平行于脂质酰基链轴定向或限制在双层的中心,平行于表面。它对两亲酰基链的角度重新定向非常敏感[39]。正如 DPH 所揭示的,流动性增加可能与 DSPE 链在其他酰基链之间插入的影响和 pHLIP 在极性头基区分配的影响有关,这改变了表面活性剂的堆积特性。 (图3)。
<图片>
pHLIP与囊泡膜相互作用的表征
对所检查的制剂进行了进一步的表征研究。使用和不使用 pHLIP 制备的所有样品均在 4°C 温度下储存 90 天,以通过测量囊泡的大小和 ζ 电位变化来评估囊泡随时间的稳定性(附加文件 1:图 S2)。在整个实验过程中没有观察到尺寸和 ζ 电位的显着变化;因此,所有检查的制剂在4°C的温度下储存都是稳定的。
此外,在 90% (v /v ) 人血清并在 37°C 下储存 3 小时(附加文件 1:图 S3)。
与人血清接触时,Tween20 囊泡显示出尺寸增加,但仍低于 300 nm。在 3 小时的实验中测量的大小和 PDI 值是恒定的,表明悬浮液中的囊泡在整个实验过程中保持完整。
与人血清接触的两个 Span20 样品都显示出尺寸增加,尤其是在使用 pHLIP 的制备中,而 PDI 值表明尺寸分布均匀(数据未显示)。该事件可能是由于静电相互作用导致血浆蛋白在 niosomal 表面的吸收,但不会导致囊泡破裂。这一假设得到了囊泡与人血清接触后 ζ 电位降低的支持。这种现象发生在 ζ 电位在中性区附近达到微负值时,使系统不稳定,囊泡开始聚集。
与 Tween20 一样,与接触前样品相比,DMPC 囊泡的尺寸也有所增加。然而,这种变化并不显着,尺寸值保持在 280 nm (DMPC) 以下或 240 nm (DMPC + pHLIP) 以下。
根据囊泡随时间释放的钙黄绿素(亲水性探针)的量评估使用和不使用 pHLIP 制备的样品的释放能力。
通过将纯化的样品暴露于 HEPES 缓冲液或人血清,在 37 °C 的温度下进行了 24 小时的研究。如图 4 所示,Tween20 和 Tween20-pHLIP 在 HEPES 缓冲液或人血清中的钙黄绿素释放曲线非常相似。
<图片>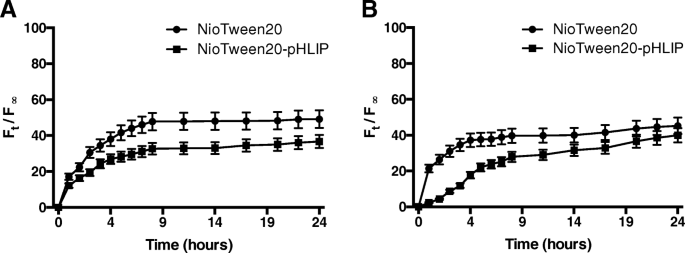
钙黄绿素释放概况。 NioTween20 和 NioTween20-pHLIP 与 HEPES 缓冲液接触 (a ) 或人血清 (b )
钙黄绿素的释放量在 30% 到 50% 之间,表明使用和不使用 pHLIP 制备的样品之间的释放能力没有差异。
Span 和 DMPC 样品获得了相同的结果(数据未显示)。
已经报道了不同刺激响应纳米载体的可比释放曲线,例如热敏立方体 [40] 或聚合物自组装纳米载体 (SAN) [41, 42]。
总之,根据插入 DSPE-pHLIP 的证据,使用和不使用 pHLIP 制备的样品在微粘度和流动性方面观察到的物理化学差异(表 3)不影响它们的释放能力(图 4)分子主要影响头基区。这些数据与之前报道的结果一致,表明在中性和高 pH 值下,pHLIP 结合到由 1-Palmitoyl-2-oleoyl-sn 制成的脂质体表面 -glycero-3-phosphocholine (POPC) 且不诱导融合或膜渗漏。
结论
该研究证实了制备 pHLIP 装饰囊泡的可能性。如果在 4 °C 温度下储存至少 3 个月且存在血清,则样品是稳定的。此外,所提出的纳米载体能够捕获亲水性探针并调节其释放。
对pHLIP囊泡进行了充分表征,以获得对纳米载体特征的基本认识,促进酸敏感纳米载体的合理设计。
The pHLIP association is driven by the hydrophobic interaction of the conjugated DSPE C18-chains inserting in the hydrophobic region of the nanovector. The pHLIP peptide is anchored and lies in the external headgroup region, prone to interact with target membranes at acidic pH and/or to release the nanovector content after bilayer rearrangement in low pH environment.
According to these findings, proposed pHLIP decorated vesicles could be useful to obtain a prolonged (modified) release of biological active substances for targeting tumors and other acidic diseased tissues.
缩写
- Chol:
-
Cholesterol
- Cryo-TEM:
-
Cryo-transmission electron microscopy
- DLS:
-
动态光散射
- DMPC:
-
1,2-Dimyristoyl-sn-glycero-3-phosphocholine
- DPH:
-
Diphenylhexatriene
- pHLIP:
-
pH (low) insertion peptide
- SAXS:
-
Small angle X-ray scattering
- Span20:
-
Sorbitan monolaurate
- Tween20:
-
Polyoxyethylenesorbitan monolaurate
纳米材料
- 用于增强药物递送的纳米纤维和细丝
- 环境响应金属-有机框架作为肿瘤治疗的给药系统
- 用于癌症应用的基于细胞的药物递送
- 具有可控厚度的二硫化钼用于电催化析氢
- 131I 追踪的 PLGA-脂质纳米颗粒作为靶向化疗治疗黑色素瘤的药物递送载体
- 加载白藜芦醇的白蛋白纳米颗粒具有延长血液循环和改善生物相容性的高效靶向胰腺肿瘤治疗
- 使用多功能 GaN/Fe 纳米颗粒靶向内皮细胞
- 具有低电阻率的紫外线固化喷墨印刷银栅电极
- 用于索拉非尼递送的基于核苷脂质的纳米载体
- 纳米粒子相关疗法的新途径
- 在低可见光反射率的 Si 纳米线阵列上均匀装饰 Cu2O 纳米颗粒制成的高效光催化剂
- 具有低工作电压的基于原子层沉积的 HfAlOx 的 RRAM,用于计算内存应用


