用于光热疗法结合免疫检查点抑制治疗转移性乳腺癌的靶向单壁碳纳米管
摘要
癌症死亡的最大原因是转移及其治疗的后果。在这里,我们提出了一种转移性乳腺癌的新疗法,该疗法将光热疗法与靶向单壁碳纳米管 (SWCNT) 和免疫刺激与检查点抑制剂相结合。我们发现,使用膜联蛋白 A5(ANXA5)功能化的 SWCNT 生物偶联物对同源 BALB/cJ 小鼠的原发性原位 EMT6 乳腺肿瘤进行选择性近红外光热消融协同增强了抗细胞毒性 T 淋巴细胞相关蛋白 4(抗 CTLA- 4) 依赖性远隔反应,导致肿瘤接种后 100 天的存活率增加 (55%)。相比之下,无论是光热疗法本身还是免疫刺激本身,都没有 100 天的存活率。在光热治疗之前,SWCNT-ANXA5 生物偶联物以 1.2 mg/kg 的相对低剂量全身给药,然后通过 ANXA5 依赖性结合在肿瘤血管系统中积累。在光热治疗期间,肿瘤的平均最高温度达到 54°C(持续时间 175 秒)。通过脾抗肿瘤免疫效应细胞的流式细胞术定量和血清细胞因子定量评估光热消融和免疫刺激联合治疗延长生存期的机制。
介绍
转移及其治疗的后果是癌症死亡的最大单一原因[1]。例如,当乳腺癌发生转移时,患者的 5 年生存率低于 25%。尽管在过去 60 年里,超过 200 种新型抗肿瘤药物改善了患者的预后,但转移性疾病的总生存率仍然很低 [2]。在这里,研究了一种由靶向肿瘤的单壁碳纳米管 (SWCNT) 生物偶联物和抗细胞毒性 T 淋巴细胞相关蛋白 4(抗 CTLA-4)检查点抑制促进的光热疗法的新组合,用于治疗转移性乳腺癌。原位小鼠模型。
单壁碳纳米管作为纳米材料的独特特性引起了人们对其作为抗癌潜在工具的极大兴趣。虽然单壁碳纳米管发挥了多种生物学效应,但单壁碳纳米管在癌症治疗中的应用主要集中在它们与近红外 (NIR) 光的相互作用以及由此产生的光热效应,其中,单壁碳纳米管在称为光热疗法的过程中迅速加热肿瘤(PTT)。许多团体已经研究了 SWCNT 在多种乳腺癌模型中用于基于 PTT 的治疗策略的潜力 [3,4,5,6,7,8,9,10]。这些工作主要集中在PTT治疗深度不超过几毫米的原发性肿瘤的能力上,其中近红外光的衰减几乎完成。
早些时候,我们表明使用温和的 NIR 激光结合光热增强 SWCNT 生物偶联物几乎可以完全消除同源小鼠的原发原位乳腺肿瘤 [11]。在这种生物共轭物中,SWCNTs 被蛋白膜联蛋白 A5 (ANXA5) 功能化,它以高亲和力结合在肿瘤细胞和肿瘤血管系统的内皮细胞上表达的阴离子磷脂磷脂酰丝氨酸,但不在血管系统的正常细胞上表达。 12,13,14]。该偶联物使用原子力显微镜 (AFM) 进行可视化,显示偶联物的高度介于 2.5 和 5.0 nm 之间,这与其他 SWCNT-蛋白质偶联物的高度相似 [11]。虽然能够根除这种先前转移模型中的原发肿瘤,但光热疗法仅能适度延长生存期。然而,我们发现初步证据表明,同时使用环磷酰胺等免疫调节剂治疗能够提高生存率。
最近,免疫调节剂(如环磷酰胺)协同增强 SWCNT 定向 PTT 的潜力引起了人们极大的兴趣。一类有前景的免疫调节剂是检查点抑制剂。检查点抑制剂是抗体,例如抗 CTLA-4、抗 PD-1 和抗 PDL-1,它们结合负责调节身体对癌症反应的关键细胞蛋白。这些抗体阻断了关键的生物“检查点”,身体可以在这些“检查点”中下调免疫系统对癌症的反应。这些蛋白质通常在控制身体的免疫反应方面发挥重要作用。通过阻断这些蛋白质的作用,检查点抑制剂消除了免疫系统通常抑制其天然抗肿瘤反应的机制。最近,几个研究小组观察到,抗 CTLA-4 检查点抑制与 SWCNT 增强 PTT 的组合有可能促进乳腺癌的强大免疫反应 [15, 16]。
在当前的研究中,我们评估了我们的新型 PTT 模式与免疫刺激剂抗细胞毒性 T 淋巴细胞相关蛋白 4(抗 CTLA-4)的组合。最初批准用于治疗转移性黑色素瘤 [17],抗 CTLA-4 现在正在与其他免疫刺激剂联合的临床试验中测试用于治疗乳腺癌 [18]。我们评估了PTT联合抗CTLA-4检查点抑制增强抗肿瘤免疫的机制,以及SWCNTs在靶器官中的长期命运。
材料和方法
材料
编码 ANXA5 的质粒 pET-30 Ek/LIC/ANX,先前已在该实验室构建 [11]。牛血清白蛋白 (BSA)、Triton X-100、EDTA、β-巯基乙醇、苯甲基磺酰氟 (PMSF) 和 Tris-乙酸盐-EDTA 缓冲液来自 Sigma-Aldrich(密苏里州圣路易斯)。磷酸钠和十二烷基硫酸钠 (SDS) 来自 Mallinckrodt Chemicals (Phillipsburg, NJ)。 HPLC 级乙醇来自 Acros Organics (Waltham, MA)。 His-trap 柱来自 GE Healthcare (Chicago, IL)。流式细胞术染色缓冲液、固定/透化缓冲液、透化缓冲液、显色内毒素定量试剂盒和 Slide-A-Lyzer 透析盒(3.5 kDa)来自 Thermo Fisher Scientific(Waltham,MA)。 2 kDa 和 100 kDa 透析膜来自 Spectrum Laboratories (Rancho Dominguez, CA)。 Roswell Park Memorial Institute 细胞培养基 (RPMI-1640) 和 Hank 平衡盐溶液来自 ATCC (Manassas, VA)。胎牛血清 (FBS) 来自 Atlanta Biologicals (Lawrenceville, GA)。胰蛋白胨、酵母提取物和卡那霉素单硫酸盐购自 Alfa Aesar (Ward Hill, MA)。氢氧化钠、氯化钾和氯化钠来自 VWR Inc (Radnor, PA)。 HRV-C3 蛋白酶来自 Sino Biologics (Portland, OR)。抗 CTLA-4 小鼠单克隆抗体(克隆:9H10)和小鼠细胞因子 ELISA 试剂盒(TNF-α、IFN-γ、IL-6)购自 BioLegend(加利福尼亚州圣地亚哥)。 CoMoCAT SWCNT(平均直径 0.8 ± nm,平均长度 1.5 ± 0.5 µm)来自 CHASM(波士顿,马萨诸塞州)。已知 CoMoCAT 方法可产生少量 (n ,米 ) 具有高选择性的手性 [19]。本研究中使用的样品高度富含 [5, 6] SWCNT,其在 980 nm 波长处表现出强烈的 NIR 光吸收。这种吸收对应于这种类型的纳米管在一个被占据的范霍夫奇点到相应的未被占据的奇点之间的 S11 跃迁。因此,为了最大限度地提高沉积在肿瘤上的 SWCNT 的辐射吸收,本研究中使用的激光波长为 980 nm,与 S11 光学跃迁的波长完全匹配 [20]。附加文件1中的图S1显示了荧光光谱,清楚地显示了用可见光激发S22跃迁后的S11 NIR发射。
细胞培养
来自 ATCC(马纳萨斯,弗吉尼亚州)的 EMT6 乳腺癌细胞在 Waymouth 的 MB 752/1 培养基中培养,该培养基含有 2 mM L-谷氨酰胺,并辅以 15% FBS。所有细胞在 37°C 和 100% 湿度和 5% CO2 下生长。使用 0.53 mM EDTA 中的 0.25% (w/v) 胰蛋白酶对所有细胞进行传代。通过STR检测(Charles River)确认细胞谱系和无支原体状态,并通过鲎实验检测为无内毒素。
ANXA5 和 SWCNT-ANXA5 生产
SWCNT-ANXA5 偶联物是使用我们之前开发的程序制备的,该程序提供 2.5 mg ANXA5/mg SWCNT [11]。简而言之,E。大肠杆菌 用编码 ANXA5 的质粒转染的 pET-30 Ek/LIC/ANX,使用固定化 Ni 2+ 的固定化金属亲和层析进行生长和纯化 分离 ANXA5,其中涉及酶促裂解以去除 (His)6 标签。使用 20 W 探针超声处理和 29,600 g 离心各 30 分钟的两个循环,将冷冻干燥的 CoMoCAT SWCNT 分散在 1% 十二烷基硫酸钠 (SDS) 中。悬浮的 SWCNT 通过 NIR 荧光(附加文件 1:图 S1)进行表征,然后与 1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚乙二醇-马来酰亚胺(DSPE-PEG-马来酰亚胺)接头共轭 30 分钟在室温下允许 SWCNT 和 DSPE 官能团之间的疏水相互作用。然后在蒸馏水中透析 8 小时以去除多余的接头和 SDS。然后将透析的偶联物与含有一个半胱氨酸基团的 ANXA5 反应 2 小时,并用 1.5 mg ml -1 封闭 L-半胱氨酸。最终产物 SWCNT-ANXA5 用 20 mM 磷酸钠缓冲液透析 8 小时以去除过量的 ANXA5 和 L-半胱氨酸。通过 SDS-PAGE 表征蛋白质重量和纯度。通过紫外-可见-近红外荧光光谱、傅里叶变换红外光谱 (FT-IR) 拉曼分析和布拉德福德分析(附加文件 1:图 S2)表征生物共轭物的 SWCNT 和 ANXA5 含量。
体内研究
所有程序均符合俄克拉荷马大学机构动物护理和使用委员会 (IACUC) 批准的协议。使用 6 周龄的雌性 BALB/cJ 雌性小鼠 (Jackson Laboratory, Bar Harbor, ME)。小鼠被喂食标准食物。在近红外激光光热照射肿瘤过程中,使用鼻锥用2%异氟醚和98%氧气麻醉小鼠。
原位注射10 6 诱导肿瘤 将 100 µL PBS 中的 EMT6 小鼠乳腺癌细胞放入 IV 乳腺脂肪垫中。允许肿瘤生长 12 天,当它们的体积达到 60 毫米 3 (直径~ 5 毫米),小鼠接受全身静脉注射。通过侧尾静脉注射 1.2 mg/kg SWCNT-ANXA5(mg SWCNT/kg 体重)生物偶联物。 3 小时后,用能量和功率水平为 175 J/cm 2 的 NIR 光 (980 nm) 照射超过肿瘤边界 5 mm 的区域 和 1 W/cm 2 ,分别(时间为 175 秒;Diodevet-50 NIR 激光器,B&W Tek Inc., Newark, DE)。检查点抑制是通过串行 IP 实现的。在肿瘤接种后第 8、11 和 16 天,在 100 µl PBS 中施用 200 µg 抗 CTLA-4 抗体。使用修正的椭球公式 \(V =\frac{1}{2} \times {\text{length}} \times {\text{width}}^{2}\) 使用卡尺测量计算肿瘤体积最长尺寸和垂直宽度。肿瘤温度由手持式 FLIR TG165 Spot 热像仪(Raymarine ITC,Fareham,UK)监测,该相机设置为自动扫描最高检测温度。摘取靶器官进行毒性评价,10%中性缓冲福尔马林固定,制备福尔马林固定石蜡包埋(FFPE)玻片,苏木精伊红染色进行毒性分析。
Ex Vivo SWCNT 检测
小鼠通过尾侧静脉全身注射 1.2 mg/kg SWCNT-ANXA5(mg SWCNT/kg 体重)。在选定的时间点,小鼠 (n =3) 被安乐死,尸体解剖,并取出靶器官进行分析。组织样品的制备方法如前所述 [21]。然后使用NS3 NanoSpectralyzer(Applied NanoFluorescence,Houston,TX)通过相对NIR荧光光谱测定离体组织样品中SWCNT的存在。
流式细胞术
小鼠在治疗后 14 天被安乐死,并如前所述对脾脏抗肿瘤免疫效应细胞进行定量 [21]。
细胞因子检测
按照上述处理后,小鼠 (n =4-5) 在光热疗法后 7 天被安乐死以进行采血。根据供应商的方案,通过ELISA定量稀释血清样品中肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)和白细胞介素6(IL-6)的浓度。
统计分析
用Graphpad Prism软件分析数据。使用单向方差分析和 Tukey-Kramer 多重比较检验评估统计显着性。生存曲线的统计显着性由 Mantel-Haenszel 对数秩检验确定。通过单向方差分析和邓尼特多重比较检验分析细胞因子血清浓度的统计显着性。多重比较由 Bonferroni 阈值校正。误差以图形方式表示为平均值的标准误差,除非误差不超过绘制的平均点符号的大小,在这种情况下,为了清楚起见,条形被排除在外。
结果
热动力学
使用 1.2 毫克/千克 SWCNT-ANXA5 的剂量,在近红外光治疗过程中记录了肿瘤的最高温度,如图 1 所示。在照射前接受 SWCNT-ANXA5 的小鼠具有更高的肿瘤温度。与接受生理盐水的小鼠相比,整个 NIR 光处理。接受 SWCNT-ANXA5 的小鼠的肿瘤平均温度与接受生理盐水的小鼠的肿瘤平均温度显着不同(54°C 对 37°C,p <0.05)。由于这种增强的光热疗法,仅在 SWCNT-ANXA5 组中发生了可见的肿瘤消融。肿瘤消融的特点是快速变色,然后是皮肤挛缩和皱纹的出现。在 48 小时内,在光热烧蚀部位形成了明显的焦痂。皮肤完全再生需要数周时间。
<图片>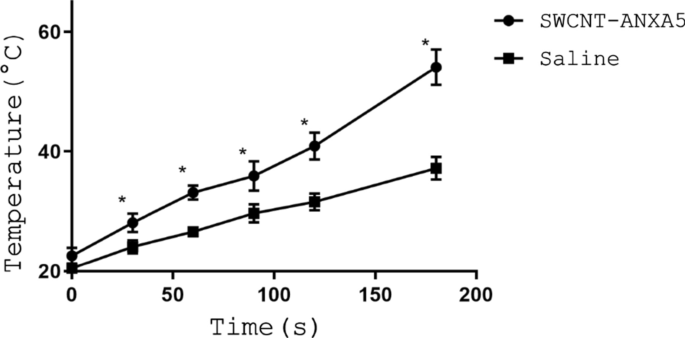
用 980 nm 的 NIR 光辐射肿瘤产生的热动力学。携带 EMT6 肿瘤的 BALB/cJ 小鼠通过 i.v. 注射。在尾静脉中使用 1.2 mg/kg SWCNT-ANXA5。等待 3 小时以清除循环中的 SWCNT 后,用能量和功率密度为 175 J/cm 2 的 NIR 激光照射肿瘤 和 1 W/cm 2 , 分别 (t =175 秒)。将肿瘤的最高温度记录为时间的函数。在t接受SWCNT的小鼠的肿瘤温度显着高于接受生理盐水的小鼠 =175 s (p <0.05)。数据表示为平均值 ± SE (n =3)
光热疗法和检查点抑制
将光热疗法与使用抗 CTLA-4 单克隆抗体的检查点抑制相结合的结果如图 2 所示。虽然单独的光热疗法很容易根除原发性乳腺癌肿瘤,但 NIR 激光无法穿透超过几毫米,这限制了治疗乳腺癌转移。为了克服局部近红外光热抗肿瘤治疗的不足,我们探索了这种独特的治疗方式与全身检查点抑制的结合(图 2)。虽然光热疗法在破坏原发性 EMT6 肿瘤方面表现出色(图 2a),但这种治疗未能根除转移,仅适度增加了携带 EMT6 原位肿瘤的小鼠的存活率(图 2b)。相比之下,抗 CTLA-4 检查点抑制提高了总体存活率,但只是暂时延迟了原发肿瘤的生长。虽然这两种疗法都没有单独提高总生存率,但 SWCNT-ANXA5 增强的光热疗法和抗 CTLA-4 检查点抑制的组合提高了总生存率,导致接种肿瘤后 100 天的生存率达到 55%。
<图片>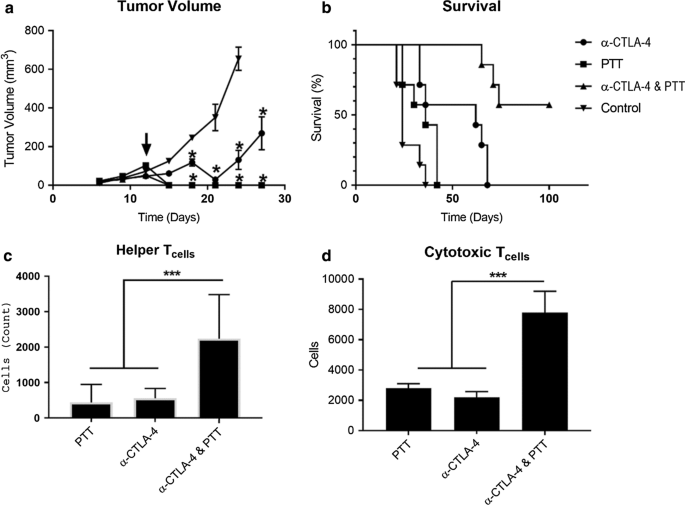
EMT6 肿瘤中组合光热疗法 (PTT) 和检查点抑制 (anti-CTLA-4) 的结果。具有发育良好的原位同基因肿瘤的小鼠 (d ≥ 5 mm) 进行静脉注射。 1.2 mg/kg SWCNT-ANXA5 的全身剂量。 一 然后在用 NIR 激光以 1 瓦/厘米的功率密度照射(箭头)175 秒后监测肿瘤体积 2 接种后第 12 天。除 PTT 外,选定组在第 8、11 和 16 天接受抗 CTLA-4(100 µg)。对照组小鼠静脉注射。用生理盐水。肿瘤体积显示为平均值 ± SE (n =7)。与对照相比的显着性由 * (p <0.05)。 b 与对照组相比,光热疗法和免疫检查点抑制的组合显着提高了存活率 (p <0.05, n =7)。 c , d 只有当小鼠接受光热疗法联合抗CTLA-4检查点抑制时,CD4 + 的相对数量才显着增加 和 CD8 + PTT 后 2 周观察脾细胞。脾细胞显示为平均值 ± SE (n =3)。显着性由 *** (p <0.005)
治疗后脾效应细胞的细胞计量学分析揭示了接受组合光热疗法和检查点抑制的小鼠提高存活率的推定机制。用 EMT6 接种小鼠并如前文所述进行处理。治疗两周后,处死小鼠,量化多种免疫效应类型的百分比和相对数量。评估了辅助 T 细胞、细胞毒性 T 细胞、中性粒细胞、髓源性抑制细胞 (MDSC) 单核细胞、FoxP3 调节性 T 细胞和巨噬细胞的数量(附加文件 1:图 S3)。对这些群体的分析揭示了治疗群体和对照组之间的显着差异,仅在同时接受光热疗法和抗 CTLA-4 检查点抑制的小鼠中。在接受这种组合的动物中,我们观察到辅助 T 细胞 (CD4 + ) 和细胞毒性 T 细胞 (CD8 + ), (图 2c, d)。 CD4 + 增加 和 CD8 + 细胞计数与尸检后观察到的脾脏大小总体增加相关。
除了对脾效应细胞进行细胞计数分析外,还在 PTT 后 7 天测定血清细胞因子浓度,以帮助阐明抗肿瘤免疫的机制。促炎细胞因子 IL-6、IFN-γ 和 TNF-α 的水平如图 3 所示。与未治疗的对照组相比,单独的 SWCNT 和抗 CTLA-4 治疗均未显着增加细胞因子的水平。然而,单独的 PTT 治疗能够显着增加 TNF-α。在PTT治疗中进一步加入抗CTLA-4可显着增加TNF-α、IL-6和IFN-γ的水平。
<图片>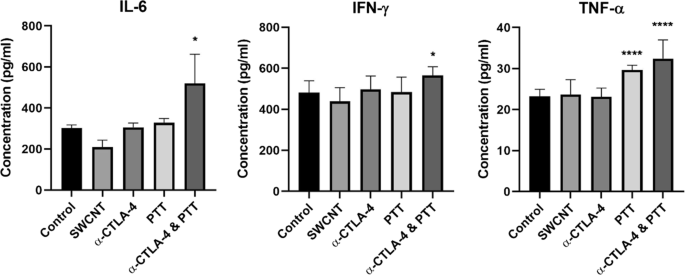
血清细胞因子浓度。 PTT 后 7 天小鼠血清中血清细胞因子水平的定量显示,PTT 和检查点抑制(抗 CTLA-4)后小鼠的 IL-6、IFN-γ 和 TNF-α 水平显着增加。结果显示为未处理的对照、仅SWCNT处理、仅抗CTLA-4处理、PTT处理和PTT + 抗CTLA-4处理。数据表示为平均值 ± SE (n =4–5)。通过单向方差分析和 Dunnett 多重比较检验,分析了治疗组与未治疗对照组的统计显着性。统计显着性由 * (p <0.05) 和 **** (p <0.0001)
SWCNT-ANXA5 的生物分布和毒性
与标准相比,通过对非原位组织裂解物中的 SWCNT 进行荧光定量来监测 SWCNT-ANXA5 在各种器官中进行光热治疗增强后的生物分布(附加文件 1:图 S4)。在静脉注射后 4 个月内跟踪靶器官中的生物分布。在健康小鼠中注射 1.2 mg/kg SWCNT-ANXA5(图 4a、b)。相比之下,根据先前描述的注射方案,在给药后 3 小时确定给药后携带 EMT6 肿瘤的小鼠中 SWCNT-ANXA5 的积累。 (治疗研究中进行光热治疗的时间。)在器官收获前的 4 个月期间,监测小鼠的身体副作用和异常行为。在此期间注射 SWCNT-ANXA5 的任何小鼠均未观察到副作用。研究结束时,在检查来自靶器官的苏木精和伊红染色的 FFPE 切片期间未观察到组织病理学毒性(附加文件 1:图 S5)。
<图片>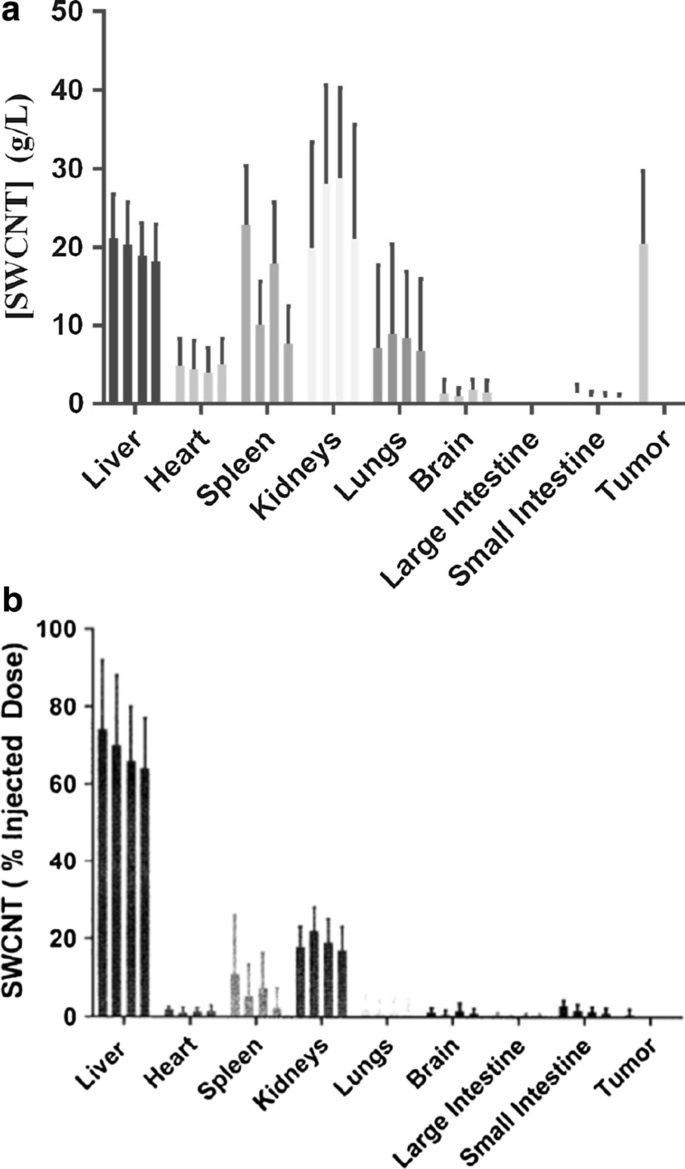
SWCNT-ANXA5 的生物分布测量为注射剂量的百分比 (a ) 和以 g/L 为单位的组织浓度 (b )。 SWCNT-ANXA5 偶联物是 i.v.以 1.2 mg/kg 的剂量注射到 Balb/cJ 小鼠中。在 1、2、3 和 4 个月后(从左到右),在没有肿瘤的小鼠的各个器官中测量 SWCNT 浓度。对于患有肿瘤的小鼠,在光热疗法治疗之前立即测量 SWCNT 的浓度。数据显示为平均值 ± SE (n =3)
讨论
这里提供的数据为结合靶向光热疗法和免疫检查点抑制治疗转移性乳腺癌的有效性提供了支持。这种现象被称为“远隔效应”,它描述了局部辐射启动抗肿瘤反应的能力,该反应抑制远离主要靶标的肿瘤生长。早在 1950 年代,研究人员就观察到局部肿瘤照射对远处肿瘤有显着影响 [22]。研究已经确定,远隔效应的全身性质是由于宿主的免疫反应 [23,24,25]。虽然 γ 辐射一直是大多数远隔研究的主要焦点,但越来越多的工作表明光热疗法也可以诱导远隔效应。大量研究表明,热消融与检查点抑制剂抗 CTLA-4 结合可产生增强的免疫反应 [16, 26,27,28,29]。我们在乳腺癌 EMT6 模型中观察到靶向光热消融和抗 CTLA-4 阻断后类似的远隔反应。
图 2a、b 中的数据说明了远隔效应。原位 EMT6 肿瘤在接受光热疗法治疗时生长迅速并已转移。这就是为什么仅接受光热疗法治疗的肿瘤小鼠与未治疗的对照组小鼠相比存活率仅略有增加的原因,即使原发肿瘤已完全消融。与对照相比,单独施用抗 CTLA-4 延迟了肿瘤生长,并将存活时间延长至 68 天,但并未治愈。 Jure-Kunkel 等人观察到 EMT6 肿瘤生长延迟的类似结果。当给予抗 CTLA-4 时 [30]。对于光热疗法和抗CTLA-4联合治疗,55%的接受治疗的小鼠在接种肿瘤后100天存活并且可能治愈。
通过使用流式细胞术量化脾脏中免疫效应细胞的数量,评估了对抗肿瘤免疫机制的洞察。与单独的光热疗法或抗 CTLA-4 相比,联合疗法导致辅助 CD4 + 增加了七倍 T 细胞和细胞溶解性 CD8 + 增加三倍 T 细胞,这两个结果都具有高度的统计学意义 (p <0.005)。这些结果进一步证明了光疗和T细胞共刺激疗法与免疫检查点抑制相结合的潜在远隔反应。
CD4 + 增加 和 CD8 + 细胞计数与尸检期间观察到的脾脏大小的增加相关。脾脏大小增加表明免疫反应增强。脾脏由多种细胞类型组成,其中最常见的是 CD4 + , CD8 + 和 B 细胞谱系 [31, 32]。虽然在这部分工作中没有探讨,但我们预计 B 细胞计数会随着 CD4 + 增加 和 CD8 + T 细胞计数 [33]。辅助 CD4 + T 细胞通过细胞因子刺激和直接细胞间相互作用促进其他免疫细胞,从而辅助体液免疫。细胞溶解 CD8 + T细胞直接杀死肿瘤细胞。 CD4 + 增加 和 CD8 + 细胞计数表明全身性远隔免疫反应。
小鼠血清促炎细胞因子水平的增加进一步支持了联合治疗后全身性远隔免疫反应的存在(图 3)。 TNF-α 激活肿瘤相关巨噬细胞以呈现抗肿瘤作用 [34, 35]。 IFN-γ 在肿瘤监测中起着重要作用 [36, 37]。 IL-6 促进巨噬细胞和淋巴细胞的增殖 [38]。 PTT联合抗CTLA-4治疗7天后小鼠血清中这些效应分子的显着增加进一步支持了抗肿瘤免疫反应的存在。
在接受 SWCNT 的小鼠照射结束时,平均最高肿瘤温度为 54°C;这个温度足以完全消融肿瘤(图 1)。这在 45-60°C 范围内,发生酶失活和线粒体损伤 [39]。盐水对照组的肿瘤温度保持在 40°C 以下,该温度提供的治疗益处最小[39,40,41]。
我们观察到,基于浓度的 SWCNT-ANXA5 的大部分积累主要在肝脏、心脏、脾脏、肾脏、肺和肿瘤中(图 4a)。在患有 EMT6 肿瘤的小鼠中,我们观察到 SWCNT-ANXA5 的浓度与肝脏和肾脏中的相似(图 4a、b)。在大脑、大肠和小肠中检测到微量的 SWCNT-ANXA5。值得注意的是,基于注射剂量 (ID) 百分比的 SWCNT 的生物分布与目标组织内 SWCNT 的绝对浓度没有很好的相关性。这主要是由于器官重量之间的差异。例如,器官内给定的 % ID 将对应于较小器官内的较高浓度和较大器官内的较小浓度。根据 SWCNT 浓度比较样品表明,肾脏内的浓度最高,其次是肝脏和脾脏(图 4a)。
在生物分布研究期间,有一些证据表明 SWCNT 在各个器官中发生降解(图 4a、b)。基于先前发现多壁碳纳米管在巨噬细胞中降解 [42],预计 SWCNT 在器官中会降解。我们研究中使用的 SWCNT 的平均直径为 0.8 纳米,平均长度为 1500 微米。根据 Zhu 等人的一项研究,预计这种大小不会具有细胞毒性。 [43],他根据长度和直径对碳纳米管毒性对脂质双层损伤的可能性进行了分类。根据这一分类,我们使用的 SWCNT 属于“生物软”类别,最大限度地减少了细胞毒性,这与我们在小鼠研究中的观察结果一致,在这些小鼠研究中,我们没有观察到由于施用 SWCNT 的任何副作用或组织病理学毒性-ANXA5结合物。
结论
在这里,我们展示了一种新的组合治疗方式,使用 SWCNT-ANXA5 生物偶联物的光热疗法结合基于抗 CTLA-4 的检查点抑制,我们在患有侵袭性转移性乳腺癌的小鼠中获得了相对较高的存活率。肿瘤血管靶向蛋白 ANXA5 的使用最大限度地减少了以低一次性剂量根除原发性肿瘤所需的全身性单壁碳纳米管的数量。有趣的是,我们注意到接受组合疗法治疗的转移性癌症小鼠的存活率增加,即使只照射原发肿瘤。一项量化重要脾抗肿瘤效应细胞数量的机制研究表明,只有两种治疗方式的结合才能增加 CD4 + 的数量 助手和 CD8 + 细胞毒性 T 细胞。我们假设 T 细胞的这种增加反映了远隔反应,其中抗肿瘤效应细胞抑制了肿瘤转移。虽然在给药后 4 个月仍发现 SWCNTs 存在于器官中,但在实验过程中未观察到任何副作用或明显的组织毒性。
数据和材料的可用性
所有数据完全可用,不受限制。
缩写
- SWCNT:
-
单壁碳纳米管
- ANXA5:
-
膜联蛋白A5
- 反 CTLA-4:
-
抗细胞毒T淋巴细胞相关蛋白4
- EDTA:
-
乙二胺四乙酸
- SDS-PAGE:
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
- DSPE:
-
1,2-Distearoyl-sn-glycero-3-phosphoethanolamine
- PTT:
-
光热疗法
纳米材料
- 碳纳米管突破了柔性电子产品的极限
- 用于癌症治疗的纳米粒子:当前的进展和挑战
- 用于 NIR-II 光热疗法的 BSA 涂层金纳米棒
- 基于多壁碳纳米管和石墨纳米片的混合复合材料的电性能
- LiNi0.8Co0.15Al0.05O2/碳纳米管的机械复合材料具有增强的锂离子电池电化学性能
- 131I 追踪的 PLGA-脂质纳米颗粒作为靶向化疗治疗黑色素瘤的药物递送载体
- 加载白藜芦醇的白蛋白纳米颗粒具有延长血液循环和改善生物相容性的高效靶向胰腺肿瘤治疗
- 通过羟基调节碳纳米管的滑滚运动模式
- 用于光热疗法的聚多巴胺碳点的简便一锅法合成
- Carbon Dots @ Platinum Porphyrin Composite 作为用于有效光动力癌症治疗的治疗诊断纳米剂
- 具有疏水修饰的普鲁兰多糖纳米颗粒的米托蒽醌新型递送抑制膀胱癌细胞以及纳米药物大小对抑制效率的影响
- 用碳纳米管和石墨烯改性的 FeF3·0.33H2O 高性能正极材料,用于锂离子电池


