通过聚乙二醇化脂质体改善蟾蜍灵的抗肿瘤功效和药代动力学
摘要
据报道,蟾蜍灵具有很强的药理作用,包括强心、抗病毒、免疫调节,尤其是抗肿瘤作用。本研究的目的是确定负载蟾蜍灵的聚乙二醇化脂质体与由 FDA 批准的药用赋形剂制备的蟾蜍灵实体相比的表征、抗肿瘤功效和药代动力学。采用薄膜蒸发法和高压均质法相结合的方法制备了负载蟾蜍灵的聚乙二醇化脂质体和负载蟾蜍灵的脂质体,具有均匀的粒径。它们的平均粒径分别为 127.6 和 155.0 nm,平均 zeta 电位分别为 2.24 和 - 18.5 mV,截留效率分别为 76.31% 和 78.40%。体外释放曲线显示蟾蜍灵在负载蟾蜍灵的聚乙二醇化脂质体中的释放比在负载蟾蜍灵的脂质体中的释放慢。空白脂质体的细胞毒性在可接受的范围内,而负载蟾蜍灵的聚乙二醇化脂质体与蟾蜍灵实体相比,对 U251 细胞的细胞毒性增强。体内药代动力学表明,负载蟾蜍灵的聚乙二醇化脂质体可以延长或消除蟾蜍灵在大鼠血浆中的半衰期。结果表明,负载蟾蜍灵的聚乙二醇化脂质体提高了溶解度,增加了血浆药物浓度。
背景
癌症疾病具有巨大的全球意义,因为到 2020 年,每年增加的癌症患者人数可能会增加一半 [1]。由于血脑屏障(BBB)和多药耐药性的存在,胶质瘤是临床上缺乏有效治疗药物的最危及生命的疾病之一[2]。蟾蜍灵已从 Venenum Bufonis 中分离和鉴定 ,这是蟾蜍的皮肤和腮腺的分泌物蟾蜍 gargarizans 康托尔或黑蟾蜍 施耐德[3]。据报道,它具有很强的药理作用,包括强心、抗病毒、免疫调节,尤其是抗肿瘤作用 [4,5,6,7]。但由于溶解性差,在水溶液中难以分散,限制了应用[8]。
脂质体被认为是一种新的给药系统,可以改善药物在水溶液中的溶解度差,提高生物利用度,提高治疗效率,减少副作用[9]。主要是,它可以帮助加载的代理通过 BBB 并传递到大脑 [10]。然而,脂质体制剂的主要缺点之一是由于血浆蛋白被脂质体的磷脂膜吸收而从血液中快速清除,随后引发单核吞噬系统对脂质体的识别和摄取。幸运的是,当在脂质体表面修饰聚乙二醇 (PEG) 时,这种吞噬作用可能会很缓慢。因此,有必要研究负载蟾蜍灵的聚乙二醇化脂质体作为长循环脂质体,以增加其水溶性并改善其药代动力学[11]。
迄今为止,蟾蜍灵的药代动力学研究尚未引起重视。一些报道仅关注口服给药水溶液中游离蟾蜍灵的药代动力学。在本研究中,我们开发了聚乙二醇化脂质体作为蟾毒灵的递送系统,并比较了载蟾毒灵的聚乙二醇化脂质体、载蟾蜍灵脂质体和蟾毒灵实体水溶液在大鼠体内的药代动力学差异。
方法
化学品和试剂
蟾毒灵(纯度≥ 98%)购自宝鸡晨光科技发展有限公司(中国陕西宝鸡)。 L-α-磷脂酰胆碱、胆固醇和 1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)-2000](铵盐;DSPE-PEG2000)购自 Sigma Chemical Co., Ltd.(美国密苏里州圣路易斯)(这些物质的分子式显示在附加文件 1:图 S1 中)。所用乙腈为光谱级,购自 Honeywell(美国)。氯仿和酒精(分析纯)购自天津科米欧化学试剂有限公司(中国)。所有化学品均为分析级或高效液相色谱 (HPLC) 级。使用Millipore净水系统(Milford,MA,USA)对水进行去离子处理,并用0.22μm膜过滤。
动物和细胞
本研究严格按照美国国立卫生研究院实验动物护理和使用指南中的建议进行。该协议经第四军医大学(中国陕西)机构动物护理和使用委员会批准(批准 2015-1013-R)。所有手术均在戊巴比妥钠麻醉下进行,并尽一切努力减少痛苦。雄性 Sprague-Dawley 大鼠,最初体重 250 ± 20 g,来自第四军医大学(中国西安)。 SW620、PC-3、MDA-MB-231、A549、U251、U87和HepG2细胞系分别购自上海细胞库或第四军医大学实验动物中心,在添加10%( v /v ) 胎牛血清 (FBS) 和 1% 抗生素(100 U/mL 青霉素 G 和 0.1 mg/mL 链霉素)。细胞在 5% CO2 和 90% 相对湿度、37 °C 的环境中保持在指数生长期。
负载蟾蜍灵的脂质体的合成
使用高压均质化将脂质体制备为 10 mL 的批量。所有脂质体中使用的蟾蜍灵量相同。简言之,以蟾蜍灵、胆固醇和L-α-磷脂酰胆碱的摩尔比为10:30:60的组成制备蟾蜍灵负载普通脂质体;以蟾蜍灵、胆固醇、L-α-磷脂酰胆碱和DSPE-PEG2000的摩尔比分别为10:30:55:5合成了负载蟾蜍灵的PEG化脂质体。
将上述磷脂混合物完全分散在3 mL氯仿中,然后在50°C减压条件下通过旋转蒸发仪将氯仿完全挥发。随后,残留溶剂(如果有)通过放置在真空干燥器中过夜进行干燥,然后将制备的干燥薄膜在 10 mL 50°C 预热去离子水中以 10 mmol/mL 磷脂涡旋再水合 15 分钟。如此形成的混合物用高压均化进一步处理。均质化的压力和时间经过优化,发现在 35°C 下为 500 bar,并且该过程已循环 10 次。使用聚碳酸酯膜(0.2-μm孔径,Whatman,Maidstone,UK)立即用Lipex挤出机(ATS,加拿大)将所得脂质体悬浮液挤出两次以形成单层脂质体。空白脂质体悬液也按前述方法制备,省略加入蟾毒灵的步骤。
加载蟾蜍灵的脂质体的表征
粒子大小和 Zeta 电位
粒径和zeta 通过动态光散射技术使用 zeta 测定脂质体的潜力 电位分析仪(Delsa™ Nano,Beckman Coulter,加利福尼亚,美国)。所有蟾蜍灵脂质体均用磷酸盐缓冲盐水 (PBS) 稀释至适当浓度,然后确定大小分布和 zeta 潜在的。测量在全自动模式下进行。
高分辨率透射电子显微镜
通过高分辨率透射电子显微镜 (HR-TEM) 研究进一步表征了蟾蜍灵脂质体。负载在 300 目铜网上的蟾蜍灵脂质体悬液用 1% (w /v ) 磷钨酸。使用TEM(Hitachi H-7650,Tokyo,Japan)在200 kV加速电压下进行形态的直接成像。
诱捕效率
蟾蜍灵含量采用高效液相色谱法分析。 Shimadzu HPLC 系统(日本京都)配备 LC-20AT 泵、SPO-M20A 二极管阵列检测器、CTO-10AS VP 柱温箱和 SIL-10AF 自动进样器。所有分离均在 SinoChrom ODS-BP C18 柱(250 毫米 × 4.6 毫米,5 微米,伊利石)(伊利石,大连,中国)上进行。进样体积为 20 μL,在 296 nm 处监测柱流出物。使用 ClassVP 软件获取和处理数据。流动相由乙腈:0.1%磷酸二氢钾(用磷酸调节pH值3.8)的混合物组成,梯度洗脱(50:50,v /v )。以 1.0 mL/min 的流速进行色谱分析。为了确定包封效率,将 1.0 mL 蟾蜍灵脂质体悬浮液加入 Sephadex G50 柱并用 PBS 洗脱。收集流出物的蓝色部分并通过添加 PBS 补足 10.0 mL(最终体积)。金额 (W 1) 脂质体混悬液中蟾毒灵的含量采用高效液相色谱法测定。将PBS加入另一份1.0mL蟾蜍灵脂质体混悬液中,使终体积达到10.0mL,量(W 2) 蟾蜍灵的含量同法测定。蟾蜍灵包裹在蟾毒灵脂质体中的百分比按下式计算:
$$ \mathrm{Entrapment}\ \mathrm{效率}={W}_1/{W}_2\times 100\% $$体外稳定性试验
Sephadex色谱法测定的包封率和zeta测定的粒径 在第 0、7、15、30 和 90 天,在 4°C 下储存后,使用电位分析仪评估稳定性曲线。在五个时间点,吸入 200 μL 脂质体悬浮液以确定脂质体泄漏率。立即使用Sephadex G50柱色谱分离200 μL脂质体悬浮液的游离蟾毒灵,并通过HPLC法测定游离蟾毒灵的量。脂质体渗漏率按下式计算:
$$ \mathrm{Liposomal}\ \mathrm{leakage}\ \mathrm{ratio}=\left({W}_0-{W}_X\right)/{W}_0\times 100\% $$ $$ { W}_0:\mathrm{entrapment}\ \mathrm{efficiency}\ \mathrm{tested}\ \mathrm{on}\ \mathrm{day}\ 0 $$ $$ {W}_X:\mathrm{entrapment}\ \mathrm{效率}\ \mathrm{测试}\ \mathrm{on}\ \mathrm{天}\ X $$蟾毒灵体外释放
蟾蜍灵从脂质体中的体外释放行为是使用透析袋技术在 37°C 下进行的,如前所述,并进行了一些修改。含有 10% 胎牛血清的 PBS (pH =7.4) 用作释放介质。通过在 4°C 下用 PBS 缓冲液彻底透析 4 小时,从蟾蜍灵脂质体中去除游离药物。简而言之,将 1.0 mL 蟾蜍灵脂质体悬浮液在室温下轻轻水平摇动 (120 rpm/min) 移液到透析管(Spectrumlabs,美国;MWCO 30 kDa)中。透析管保持在含有 10% 胎牛血清的 50 mL PBS (pH =7.4) 中,温度保持在 37°C。从培养基中取出透析液,并在不同的持续时间用等体积的新鲜 PBS 代替,即。 0, 0.5, 1, 2, 4, 6, 12, 24, 和 48小时。释放的蟾蜍灵浓度如前所述通过HPLC测量。
细胞毒性
使用 MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑)测定法对多种肿瘤细胞系进行体外细胞毒性研究,包括 SW620、PC-3、MDA-MB- 231、A549、U251、U87 和 HepG2。此外,选择 U87 和 U251 细胞来测量负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体对胶质瘤肿瘤细胞的细胞毒作用。 U87和U251细胞分别以1.0×10 5 接种于96孔微量滴定板 细胞/孔并使其粘附(37°C,5% CO2)24 小时,然后吸出培养基并更换为 0.1 mL 新鲜培养基。将蟾蜍灵实体、空白脂质体、空白聚乙二醇化脂质体、装载蟾蜍灵的脂质体和装载蟾蜍灵的聚乙二醇化脂质体稀释到完全培养基中并以0.1mL的总体积添加到细胞中以达到所需的最终浓度;对于对照,不添加测试溶液。对空白脂质体和空白PEG化脂质体进行评价,以测试制备蟾蜍灵脂质体所用赋形剂的毒性。 24 小时后,通过在含有 5 毫克/毫升 MTT 的生长培养基中在 37°C 下培养 4 小时来评估细胞活力。吸出培养基后,形成的甲臜结晶用 200 μL 有机溶剂溶解。已在酶标仪上在 570 nm 波长处测量吸光度。
使用高效液相色谱法对蟾毒灵脂质体进行体内药代动力学研究
药代动力学研究采用高效液相色谱技术评价蟾毒灵在普通脂质体或长循环脂质体中的吸收、分布、代谢和排泄情况,寻找蟾毒灵生物利用度的差异。
在本实验中,年轻、健康的成年雄性 Sprague-Dawley 大鼠,体重 250 ± 20 g,购自第四军医大学(中国西安)。将大鼠关在通风良好的笼子中,室温 (24 ± 2°C) 和 40-60% 的相对湿度,同时进行 12 小时的常规明暗循环。在实验前使动物适应至少 3 天。动物程序按照第四军医大学动物伦理委员会指南进行。
如前所述制备负载蟾蜍灵的脂质体、负载蟾毒灵的聚乙二醇化脂质体和水悬浮液辅助乙醇溶解中的蟾毒灵,然后分别以 0.5 mg/kg 的等效剂量静脉内给药。在注射后 2、5、15、30、45、60、90、120、240、360、600 分钟,在轻度乙醚麻醉下,从大鼠的眶窝收集血样到含有作为抗凝剂的肝素的微量离心管中。然后在 4°C 下以 3500 r/min 离心 15 分钟。分离的血浆在分析前于-20°C冷冻保存。
样本预处理
采用简单的液-液萃取方法从大鼠血液中提取蟾蜍灵和内标。向 200 μL 中加入相当于 10.0 μg 的内标溶液(20 μL 的 100 μg/mL 华蟾素工作原液)并在环混器上混合 10 秒,然后用 3.0 mL 乙酸乙酯:石油醚,1: 1(v /v ),和混合物。将混合物涡旋 5 分钟,然后在 Sigma 3-16k(法兰克福,德国)上以 4000 r/min 离心 15 分钟。分离出 3.0 mL 的等分试样并在氮气下蒸发至干,然后将残留物重新溶解在 200 μL 乙腈中。取 20 μl 上清液注入分析柱,12,000 r/min 离心 15 min 后进行分析。
药代动力学分析
观察到的最大血液浓度 (C max) 和半衰期 (T 1/2) 是通过目视检查实验数据获得的。使用中国药理学会药物临床评价数学药理学专业委员会编着的Drug and Statistics(DAS 2.1.1)对数据进行非房室药代动力学分析。数据采用二室开放模型进行分析。
统计分析
所有结果均表示为平均值 ± SD (n =3),并且使用 GraphPad Prism 5 软件通过单向方差分析 (ANOVA) 比较配方之间的差异。 P <0.05 表示在所有情况下都显着。
结果
理化性质
薄膜再水化结合高压均质技术用于制备蟾蜍灵负载脂质体和负载蟾蜍灵聚乙二醇化脂质体。薄膜再水化是合成脂质体的常规方法之一,具有成熟和受控的过程以包埋亲脂性药物。此外,匀浆循环次数对于获得均匀稳定的脂质体悬浮液也起着关键作用。
如图 1 所示,负载蟾蜍灵的脂质体和负载蟾毒灵的 PEGylated 脂质体的形态接近球形或椭圆形,如图 1 所示。脂质体均在 200 nm 以下。通过 zeta 测量,负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体的平均粒径分别为 127.6 ± 3.64 nm 和 155.0 ± 8.46 nm(图 1c) 电位分析仪(Delsa™ Nano,Beckman Coulter,加利福尼亚,美国)。与装载蟾蜍灵的脂质体相比,装载蟾蜍灵的聚乙二醇化脂质体表现出负表面电荷,表明其具有出色的稳定性(装载蟾蜍灵的脂质体 2.24 mV;装载蟾蜍灵的聚乙二醇化脂质体 -18.05 mV,附加文件 2:表 S1)。此外,zeta 的分布 潜力可以在图 1b 中看到。然而,HPLC测定的蟾蜍灵在负载蟾蜍灵的脂质体和负载蟾蜍灵的PEG化脂质体中的包封率分别为76.31 ± 3.40%和78.40 ± 1.62%。
<图片>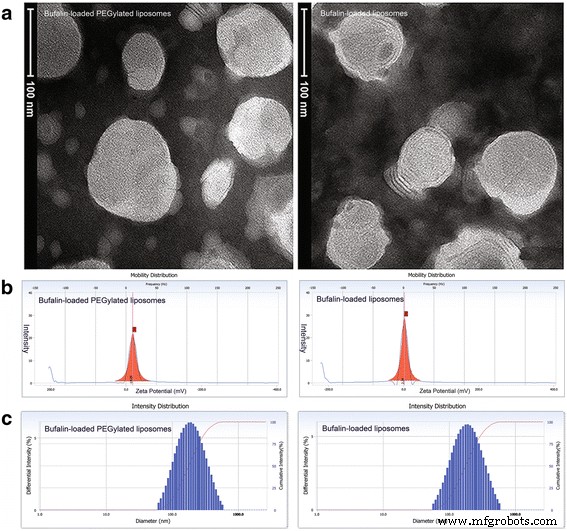
蟾蜍灵负载脂质体和蟾蜍灵负载聚乙二醇化脂质体的理化性质。 一 负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体的 TEM 图像,具有近乎球形或椭圆形的形状。 b 通过动态光散射测量的负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体的典型粒径和分布。 c 典型表面zeta 蟾毒灵脂质体和蟾毒灵聚乙二醇化脂质体的潜力
体外稳定性试验
负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体的稳定性曲线如表 1 所示。此外,还计算了脂质体泄漏率。对于装载蟾蜍灵的脂质体,在第 0、7、15、30 和 90 天,在 4°C 下的结果分别为 0.0、16.7、25.2、27.9 和 30.6%。对于装载蟾蜍灵的聚乙二醇化脂质体,结果分别为 0.0% 、5.0、8.8、14.5 和 18.0%,在 4°C,第 0、7、15、30 和 90 天。
体外释放概况
图 2 总结了负载蟾蜍灵的脂质体或负载蟾蜍灵的聚乙二醇化脂质体的蟾毒林释放曲线。从实验数据来看,在相同的溶出介质中,蟾蜍灵可以迅速扩散到含有 10% 胎牛血清的 PBS 中,没有限制,紧随其后的是蟾蜍灵-负载脂质体,最后负载蟾蜍灵聚乙二醇化脂质体。
<图片>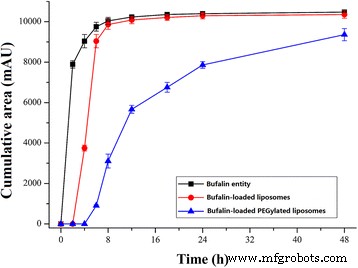
在溶出介质磷酸盐缓冲液 (pH 7.4) 中,蟾毒林从载有蟾毒灵的普通脂质体和载有蟾毒灵的聚乙二醇化脂质体中的体外释放。数据为均值 ± SD, n =3
细胞毒性
通过 MTT 测定测试时,受蟾蜍灵实体影响的几种肿瘤细胞系的细胞活力如图 3a 所示,它们的半数最大抑制浓度 (IC50) 也在附加文件 2:表 S2 中计算。 Bufalin 以剂量依赖性方式抑制多种肿瘤细胞的生长,而 IC50 的结果显示,与其他测试的癌细胞相比,bufalin 分别对 U251 和 U87 神经胶质瘤癌细胞更敏感。当与蟾蜍灵实体、蟾蜍灵负载脂质体和蟾蜍灵负载聚乙二醇化脂质体一起应用时,通过 MTT 测定进行的 U251 细胞活力如图 3b 所示。培养 12 小时后,蟾蜍灵实体、蟾蜍灵负载脂质体和蟾蜍灵负载聚乙二醇化脂质体的细胞活力表现出不同,而空白脂质体和空白聚乙二醇化脂质体的细胞活力没有变化。如上所述,在相同浓度水平下,蟾蜍灵PEG化脂质体组U251的细胞活力始终低于蟾蜍灵脂质体组;同时,蟾蜍灵实体对细胞活力的影响最小。
<图片>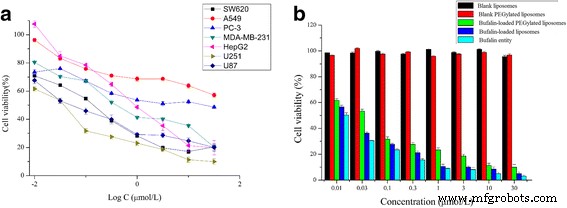
空白脂质体、空白聚乙二醇化脂质体、蟾蜍灵实体、负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体对肿瘤细胞的体外细胞毒性。 一 几种肿瘤细胞系在不同浓度的蟾蜍灵实体下的细胞活力。 b U251细胞在不同浓度空白脂质体、空白PEG化脂质体、蟾蜍灵实体、负载蟾蜍灵脂质体和负载蟾蜍灵PEG化脂质体的细胞活力
体内药代动力学研究
方法验证
基于对内标峰面积比(y ) 与浓度 (x , μg/mL) 标准溶液中七种不同浓度的蟾蜍灵。回归方程为 y =0.4238 x + 0.2429(线性范围 0.05–10.0 μg/mL)和相关系数 (R 2 ) 为 0.9965。检测限 (LOD) 值为 0.01 μg/mL,其计算为信噪比为 3 (S/N =3).
特异性、精度和回收率
通过检查来自处理过的空白血浆样品的色谱图来评估内源性物质的干扰程度。附加文件 3:图 S2 显示了空白血浆、加标蟾蜍灵的空白血浆、加标蟾蜍灵和 resibufogenin 的空白血浆(作为内标)、静脉注射蟾蜍灵实体后 30 分钟加标 resibufogenin 的血浆样品、加标静脉给药负载蟾蜍灵的脂质体后 30 分钟,以及在静脉内给药负载蟾蜍灵的聚乙二醇化脂质体后 30 分钟,血浆样品中加入了瑞溴福英。 Bufalin 和 resibufogenin 分别在大约 7.191 和 10.131 分钟洗脱。在蟾蜍灵或内标的保留时间未发现干扰和脂质体膜材料的峰。精密度和回收率测试结果如表 2 所示。
药代动力学
负载蟾蜍灵的脂质体、负载蟾蜍灵的聚乙二醇化脂质体的血药浓度-时间曲线及其与水悬浮液中蟾蜍灵实体的比较如图 4 所示。平均药代动力学参数列于表 3 中。结果表明存在其中大部分参数存在显着差异,C 负载蟾蜍灵的脂质体的最大值小于蟾蜍灵实体,而负载蟾蜍灵的聚乙二醇化脂质体的最大值最小。此外,T 负载蟾蜍灵的聚乙二醇化脂质体与蟾蜍灵实体的 1/2z 比率以及负载蟾蜍灵的脂质体与蟾蜍灵实体的比率约为 2.15 倍(87.84 分钟/40.52 分钟)(P <0.01) 和 1.34 倍(54.40 分钟/40.52 分钟)(P <0.05),分别。 AUC(0–t ) 负载蟾蜍灵的聚乙二醇化脂质体与蟾蜍灵实体以及负载蟾蜍灵的脂质体与蟾蜍灵实体的比率约为 5.49 倍 (139,157.83 ng/(mL min)/25,334.27 ng/(mL min)) (>i>P <0.01) 和 2.28 倍 (57,751.88 ng/(mL min)/25,334.27 ng/(mL min)) (P <0.01),分别。结果表明,蟾蜍灵实体在血流中被迅速清除,脂质体制剂增加了血浆中的药物浓度并经受住了清除。此外,PEG的修饰可以促进这种效果。
<图片>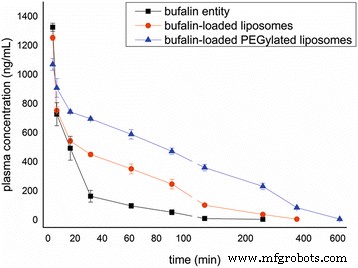
蟾蜍灵在大鼠血浆中的浓度-时间曲线
讨论
本研究采用均质膜再水化法成功制备了蟾毒灵负载脂质体和蟾毒灵负载聚乙二醇化脂质体,两者均具有最佳粒径范围和低多分散性,并且易于大批量复制。本研究发现脂质体制剂大大提高了蟾毒灵的溶解度。
Bufalin 负载的 PEGylated 脂质体表现出负表面电荷,其绝对值比具有正表面电荷的 Bufalin 负载脂质体更大。 zeta 电位主要由表面性质决定。未修饰的蟾蜍灵负载脂质体是中性的,它们的电位通常在± 5 mV 内。但是DSPE在中性条件下是不带电的,而且制备过程不能完全中性,所以DSPE带负电。同时,zeta 大分子PEG的电位约为负数毫伏,接近中性负电位。因此,在载有蟾蜍灵的脂质体上对 DSPE-PEG2000 进行表面修饰后,zeta 负载蟾蜍灵的聚乙二醇化脂质体的潜力为负。这些发现表明,DSPE-PEG2000 的表面修饰改变了脂质体的表面电位,从而增强了它们的稳定性。经体外稳定性试验证实。李等人。 [12] 采用脂质体共递送系统,将抗 CD40 mAb 偶联到用蟾蜍灵包裹的聚乙二醇化脂质体表面。脂质体由蟾蜍灵、胆固醇、EPC、DSPE-PEG2000 和 DSPE-PEG2000-Mal 的摩尔比分别为 20:55:5:5:15 组成。然后通过马来酰亚胺-硫醇反应将抗CD40单克隆抗体偶联到脂质体上,制备蟾蜍灵脂质体锚定的抗CD40。关于稳定性曲线,只提到负表面电荷表明具有良好的稳定性,没有明确和明确的数据描述。
李等人。 [13] 制备了含有 1.25% 脂质 E-80® 和 0.06% 胆固醇的载有蟾蜍二烯内酯的脂质体 (BU-lipo)。蟾蜍灵、华蟾蜍精和瑞蟾蜍精的包封率分别为 86.5、90.0 和 92.1%。考虑到磷脂的稳定性,为 BU-脂质制剂选择 pH 6.5。 BU-lipo 的性质,如 pH、PSD、zeta 在 2-8°C 下,电势和截留效率至少在 3 个月内没有变化。但是,需要严格控制储存条件。需要研究在中性pH下更稳定的制剂,以降低运输和储存成本,这是未来临床应用的考虑因素。
根据前人研究的制剂配方,我们重复了载蟾蜍灵脂质体的实验。但脂质体的稳定性不能满足生产需要。
在本研究中,负载蟾蜍灵的聚乙二醇化脂质体由蟾蜍灵、胆固醇、L-α-磷脂酰胆碱和 DSPE-PEG2000 的摩尔比分别为 10:30:55:5 组成。特别是在使用聚碳酸酯膜的Lipex挤出机挤出之前,如此形成的混合物进一步经过高压均质处理。
4℃中性pH保存3个月,两种脂质体粒径均略有增加,包封率总体略有下降,有利于临床应用。 TEM照片显示载有蟾蜍灵的脂质体表面覆盖有厚厚的三维云状结构,表明DSPE-PEG2000由于其两亲线性聚合物结构特征而在空间稳定中发挥作用。
一项体外释放研究表明,蟾蜍灵从负载蟾蜍灵的脂质体和负载蟾蜍灵的聚乙二醇化脂质体中的释放在相同的溶出介质中被延迟,而蟾蜍灵实体迅速扩散到 PBS 中而不受限制。 DSPE-PEG2000的表面修饰改变了水性边界层的屏障特性和膜的渗透性,导致蟾毒灵从脂质体中的释放速度降低。
在细胞毒性研究中,蟾蜍灵对多种肿瘤细胞的生长有明显的抑制作用,呈剂量依赖性,而IC50结果表明蟾蜍灵对U251和U87胶质瘤癌细胞的敏感性分别高于其他种类的癌细胞。 Moreover, we found that the blank liposome and blank PEGylated liposome were not toxic to cells, revealing the safety of excipients to some degree, whereas the bufalin-loaded liposomes and bufalin-loaded PEGylated liposomes showed concentration-dependent toxicity to U251 glioma cells. In addition, bufalin-loaded PEGylated liposomes showed slightly weaker cytotoxicities compared with bufalin-loaded liposomes and free bufalin. It is assumed that free bufalin was slowly released from bufalin-loaded PEGylated liposomes during incubation. And the release rate of bufalin was slower in bufalin-loaded PEGylated liposomes than bufalin-loaded liposomes. All the results might suggest that after internalization in the cells, free bufalin could be released from bufalin-loaded PEGylated liposomes and induce the apoptosis of U251 glioma cells.
The pharmacokinetic study found that significant differences of pharmacokinetic parameters among bufalin-loaded PEGylated liposomes, bufalin-loaded liposomes, and free bufalin entity did exist. After intravenous administration, free bufalin entity was swiftly cleared in the bloodstream with the highest peak concentration, whereas liposome preparation did obviously increase the drug concentration in plasma and withstood the clearance. Moreover, the surface modification of PEG could facilitate this effect. These results had provided us some information for understanding the properties of bufalin on pharmacokinetics and pharmacodynamics.
As common primary intracranial tumors, 70% of glioma tumors were malignant, including astrocytoma and glioblastoma. The micro environment of the network of glioma was composed of tumor cells, immune cells and various cytokines secreted by them, which was complex and made glioma cells intracranial metastatic easily [2]. Therefore, operations are difficult to perform, and the incomplete surgery excision commonly resulted in the poor prognosis. To these patients, radiotherapy and chemotherapy play key roles in their treatments. Nowadays, the applications of three-dimensional conformal radiation therapy and intensity-modulated radiation therapy technology can not only increase precision, dosage and efficacy, but also reduce damage in cancer therapy, so as to improve their living quality. However, the accurate radiotherapy has great risk because of the particularity of brain tissues and brain functions. Hence, medication of chemotherapeutics is relatively instrumental in glioma cancer treatment, whereas most malignant and highly aggressive glioma tumors have high relapse rates due to BBB and drug resistance [14].
Consequently, selecting a highly sensitive drug to brain glioma and making it penetrate the BBB are becoming emerging scientific subjects to resolve.
In recent years, the researches concerning bufalin have been studied in various aspects, including pharmacology, pharmacodynamics, and pharmaceutics [12, 15,16,17,18,19,20]. Fortunately, some studies found that bufalin had a broad antitumor spectrum. It was sensitive to several kinds of tumor cell lines, including lung cancer, liver cancer, melanoma, and glioma cancer. However, low solubility, heavy toxicity, and short half-life led to a narrow therapeutic index by intravenous administration and easy decomposition by oral administration, which restricted clinical application of bufalin [6]. In addition, bufalin had been reported to be hydrophobic and could only dissolve in some suspending agent or auxiliary solvent including ethanol and tween 80, which might result in some toxic effects [21].
Nevertheless, as a new drug delivery system, the liposomal formulation was considered to be a low-toxic technology with considerable potential for encapsulating lipophilic drugs [12, 22]. Some studies showed that liposome could be easier to enter tumor focus by the process of phagocytosis. Meanwhile, the vascular endothelial cell gaps in the tumor lesion was enlarged, which enhanced this process (enhanced permeability and retention effect, EPR effect) [23, 24]. Moreover, the liposome could sustain releasing antitumor agents so as to extend action time, improve drug efficacy, and decrease adverse reaction [25]. Thus, liposome formulation has a wide prospect to encapsulate antitumor agents [9].
In the previous experiments, we found that the combination chemoimmunotherapy of anti-CD40 plus bufalin by liposomal carriers could enhance anticancer therapeutic efficacy while reducing systemic toxicity, due to the confined biodistribution and prolonged release of cargo [12]. In the present study, we found that bufalin entity has a broad spectrum of anticancer activity. It could inhibit the proliferation of several kinds of tumor cells, such as lung, liver, breast, and glioma cancer cells. As an active traditional Chinese monomer, bufalin is a promising anticancer drug. It was expected to be applied to further clinical study. However, anti-CD40 mAbs has not been approved as a pharmaceutical excipient by the FDA. The toxicity and side effect of anti-CD40 mAbs is still unclear to this day.
Nevertheless, the shortcomings of conventional liposome were obvious in the meantime. Lack of membrane stability, easy oxidation of phospholipid materials, and opsonification of plasma proteins limited its application [26, 27]. By surface-modifying DSPE-PEG2000 on bufalin-loaded liposomes, bufalin-loaded PEGylated liposomes extended its blood circulation, prolonged half-life, and expanded the therapeutic window for glioma.
Therefore, we adjusted the formulation of bufalin-loaded PEGylated liposomes. On this basis, we evaluated the physicochemical properties and comprehensive characterizations both in vitro and in vivo. We characterized pharmacokinetic properties of bufalin-loaded PEGylated liposomes and compared this type of liposome with raw bufalin and non-PEGylated liposomes. Our results revealed the unknown PK properties of this type of liposomes, which will be useful to recommend dosage in a further clinical study.
Our subjects lack some tissue distribution experiments in animals, so it is not known how the liposome formulation altered the distribution of bufalin in the body. Further studies with more experiments are needed.
Conclusions
The present study demonstrated that the solubility, antitumor efficacy, and pharmacokinetics of bufalin-loaded PEGylated liposomes are improved compared with those of bufalin entity. The results suggested that PEGylated liposomal bufalin has the potential to be a good drug delivery system for glioma cancer.
纳米材料
- 用于改进诊断和治疗应用的多功能金纳米粒子:综述
- 通过溶胶-凝胶工艺制备的纳米结构二氧化硅/金-纤维素-键合氨基-POSS 混合复合材料
- 氮化处理的基于 HfO2 的 RRAM 中的传导机制和改进的耐久性
- 通过蒸发诱导自组装和增强的气敏特性简便合成虫孔状介孔氧化锡
- 通过尺寸、修饰、缺陷和掺杂设计和调整石墨烯功函数:第一性原理理论研究
- 通过海藻酸钠电解质-磺化氧化石墨烯生物膜增强质子电导率和降低甲醇渗透率
- 通过生长掺杂方法实现双发射和颜色可调的 Mn 掺杂 InP/ZnS 量子点
- 纳米藻酸盐通过反胶束合成:阿霉素封装和乳腺癌细胞毒性
- 使用冻干单相溶液法制备甘草次酸脂质体:预配制、优化和体外评估
- 双整合素 αvβ 3 和 NRP-1 靶向顺磁性脂质体,用于磁共振成像中的肿瘤早期检测
- 通过熔盐合成法合成的球状和棒状 PbTiO3 粉末的结构特征和介电特性
- 装载蟾蜍灵的聚乙二醇化脂质体:抗肿瘤功效、急性毒性和组织分布


