抑制的 MicroRNA-301 通过升高 PTEN 抑制食管鳞状细胞癌的血管生成和细胞生长
摘要
目标
食管鳞状细胞癌(ESCC)的特点是早期转移和晚期诊断。已知 MicroRNA-301 (miR-301) 参与多种癌症。然而,miR-301 对 ESCC 的影响仍有待探索。因此,我们旨在探讨miR-301在ESCC进展中的作用。
方法
评估了 miR-301 和磷酸酶和张力蛋白同源物 (PTEN) 在 ESCC 组织和细胞系中的表达。接下来,将筛选的细胞用改变的 miR-301 或 PTEN 寡核苷酸和质粒处理,然后评估 ESCC 细胞的集落形成能力、细胞活力、迁移、侵袭、细胞周期分布和凋亡。此外,还评估了肿瘤生长和微血管密度(MVD),并肯定了 miR-301 和 PTEN 之间的靶向关系。
结果
在 ESCC 组织和细胞中,miR-301 上调,PTEN 下调。选择 KYSE30 细胞和 Eca109 细胞进行功能测定。在 KYSE30 细胞中,抑制 miR-301 或过表达的 PTEN 抑制细胞恶性行为,沉默 PTEN 消除了 miR-301 抑制对 ESCC 进展的影响。在 Eca109 细胞中,miR-301 过表达或 PTEN 抑制促进了细胞恶性行为,PTEN 过表达逆转了 miR-301 升高对 ESCC 进展的影响。体内试验表明 miR-301 抑制或 PTEN 过表达抑制 ESCC 肿瘤生长和 MVD,而 miR-301 升高或 PTEN 降低具有相反的作用。此外,PTEN被miR-301靶向。
结论
总之,我们的研究结果表明,miR-301 通过调节 ESCC 中 PTEN 的表达来影响细胞的生长、转移和血管生成。
介绍
食管癌(esophageal cancer,EC)是全球第8位最常见的癌症,是一种死亡率高、预后差的危重恶性肿瘤[1]。食管鳞状细胞癌(ESCC)是中国EC的主要形式,约占EC病例总数的90%[2]。社会经济地位低下、吸烟、饮酒、营养摄入不足、富含亚硝胺或受霉菌毒素污染的食物等多种原因导致ESCC的发生[3]。尽管促进了临床结果和给药,但 ESCC 患者的预后仍然较差,5 年生存率为 15-25% [4]。因此,确定可作为ESCC发生发展的生物标志物的致癌基因或抑癌基因,为ESCC患者提供更有效的治疗方法至关重要。
MicroRNAs (miRNAs) 是小的非编码 RNAs,在调节基因表达 [5] 中发挥重要作用,并被阐明具有通过调节 mRNA 稳定性和 mRNAs 能力影响肿瘤进展的能力 [6]。已发现一定量的 miRNA,如 miR-4324 [7]、miR-889-3p [8] 和 miR-9 [9] 与 ESCC 的过程有关。 MiR-301 是 miRNA 的成员,由位于人类基因组 17q22-23 的 fam33a 转录单元形成。先前已发现 miR-301 的过度表达,这反映它与人类疾病有关 [6, 10]。然而,miR-301的功能机制尚未在ESCC中发现。此外,已证实磷酸酶和张力蛋白同源物 (PTEN) 在肿瘤中经常被破坏,并被癌症患者的种系突变靶向,其对肿瘤起抑制作用 [11]。已经证实 PTEN 的失调与 ESCC 的发展有关 [12]。有趣的是,最近的一项研究表明,miR-301 靶向非小细胞肺癌中的 PTEN [13]。然而,miR-301和PTEN在ESCC发展中的这种靶向关系仍有待揭示。我们的研究集中在 miR-301 和 PTEN 对 ESCC 进展的影响上,这些影响在很大程度上仍然未知且具有新颖性。我们推断miR-301可能通过调节PTEN表达影响ESCC的血管生成和细胞生长。
材料和方法
道德声明
在研究之前从所有患者获得书面知情同意书。本研究的方案经吉林大学第二医院伦理委员会批准,并基于赫尔辛基宣言中涉及人类受试者的医学研究伦理原则。动物实验严格遵守美国国立卫生研究院发布的《实验动物管理和使用指南》。动物实验方案经吉林大学第二医院动物护理和使用机构委员会批准。
学习科目
从1月1日起在吉林大学第二医院胸外科接受食管切除术的ESCC患者(男78例,女32例)收集110份ESCC组织及邻近正常组织(距肿瘤> 5 cm)标本。 2015年至2017年12月,110例患者中> 60岁84例, ≤ 60岁26例;肿瘤大小:65例 ≥ 5 cm和45例 <5 cm;无淋巴结转移(LNM)71例,淋巴结转移39例;肿瘤、淋巴结和转移(TNM)分期:I + II期60例,III期50例;肿瘤部位:上段食管鳞癌13例,中下段食管鳞癌97例。患者均确诊为ESCC,之前未接受过放疗或化疗。肿瘤完全切除,手术切缘阴性,经病理证实。根据国际癌症控制联盟(UICC)2009年提出的ESCC分期标准[14],患者术后病理分期确定为pT1-4N1-2(I-IIIb)分期。术后患者无明显并发症,排除围手术期死亡。
逆转录定量聚合酶链反应 (RT-qPCR)
使用 Trizol 试剂盒(Invitrogen Inc., Carlsbad, CA, USA)提取组织和细胞中的总 RNA。测量RNA浓度和质量。 RNA引物(表1)由TaKaRa生物技术有限公司(中国辽宁)设计和合成。根据Takara PrimeScript™ RT 试剂盒的说明使用g DNA Eraser (Takara) 将RNA 逆转录成cDNA。我们使用 Power PCR SYBR green PCR master mix (Takara) 在 Light Cycler 480II (Roche) 上进行 qPCR。 U6用作miR-301的上样对照,β-actin用作PTEN的内参。数据分析采用2 −△△Ct 方法[15]。
Western Blot 分析
用RIPA裂解缓冲液(Beyotime Institute of Biotechnology, Shanghai,China)提取细胞和组织中的总蛋白,用BCA Protein Assay kit(Beyotime)对蛋白进行定量。测量每个样品的蛋白质浓度,并进行 10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。将样品转移到硝酸纤维素膜上,然后用 5% 脱脂奶粉在 4°C 下封闭过夜。然后,将膜补充一抗 PTEN 和 β-肌动蛋白(均为 1:500 和来自美国加利福尼亚州圣克鲁斯生物技术公司)孵育过夜,然后加入相应的二抗并孵育 1 小时。在增强型化学发光试剂(Pierce Chemical Inc.,Dallas,TX,USA)中浸泡 1 分钟后,将膜暴露在黑暗环境中并使用 LAS4000 微型化学发光成像仪显影。灰度值由成像系统软件评估,以β-actin为对照;从而得到最终表达的相对蛋白。 ImageJ2x软件对蛋白条带进行分析。
双荧光素酶报告基因检测
预测 PTEN 的 3'-非翻译区 (UTR) 序列与 miR-301 相互作用,或合成预测靶位点内的突变序列并将其插入 pGL3 对照荧光素酶报告载体的 XbaI 和 FseI 位点(Promega, WI,美国)。然后,产生 pGL3-PTEN-wt 和 pGL3-PTEN-mut 载体。将正确鉴定的wt和mut荧光素酶报告质粒与miR-301模拟物和模拟物NC共转染到KYSE30和Eca109细胞中48小时。随后裂解细胞,分别用荧光素酶检测试剂盒(Promega)测定荧光素酶活性。
细胞培养、分组和转染
ESCC细胞系(KYSE-150、KYSE-30、Eca109和KYSE-70)购自中国科学院上海生化与细胞生物学研究所(中国上海),并获得人食管上皮细胞(HEECs)来自明洲生物科技有限公司(中国浙江)。细胞在 RPMI 1640 培养基(Invitrogen)中培养,该培养基补充有 10% 胎牛血清(FBS,Life Technologies,USA)、100 单位/ml 青霉素 G 钠(Sigma)和 100 μg/ml 硫酸链霉素(Sigma)。 RT-qPCR检测各细胞系中MiR-301表达和PTEN mRNA表达,选择相对表达最高和最低的细胞系进行后续细胞实验。
KYSE-30细胞分为7组,分别用miR-301抑制剂、抑制剂阴性对照(NC)、pcDNA-PTEN(命名为过表达(oe)-PTEN)、pcDNA-NC(命名为oe-NC)、 miR-301 抑制剂 + 小干扰 RNA (si)-PTEN 或 miR-301 抑制剂 + si-NC。 Eca109细胞也分为7组,分别用miR-301模拟物、模拟物NC、si-PTEN、si-NC、miR-301模拟物 + oe-PTEN、miR-301模拟物 + oe-NC处理。抑制剂NC、miR-301抑制剂、miR-301模拟物、模拟物NC、si-NC和si-PTEN购自GenePharma Ltd., Company(中国上海); pcDNA-PTEN NC 和 pcDNA-PTEN 获自(上海生工生物技术有限公司(中国上海))。当细胞融合度达到60%时,用lipofectamine 2000(Invitrogen)瞬时转染ESCC细胞。
细胞计数试剂盒 (CCK-8) 分析
细胞接种于 96 孔板(1 × 10 3 细胞/孔)并孵育不同的时间段。孵育24 h、48 h、72 h和96 h后,每孔加入10 μL CCK-8溶液(5 mg/mL),然后将各组细胞于37 ℃避光孵育暴露 2 小时。通过酶标仪(Bio-Rad Laboratories, Hercules, CA, USA)分析 450 nm 处的光密度(OD)值。
菌落形成分析
细胞转染后以500个细胞/孔接种于6孔板中,培养14 d。菌落甲醇固定,0.5%结晶紫染色,倒置显微镜下计数。
Transwell 检测
细胞 (5 × 10 3 ) 在 RPMI 1640 培养基中培养的细胞被接种到 Transwell 装置的顶端腔室中,该装置具有未涂覆或基质胶涂覆的膜 (Corning, NY, USA)。 24 小时后,去除顶室上的细胞,同时固定下侧的细胞,然后使用 0.1% 结晶紫染色。用显微镜(Olympus Corporation,Tokyo,Japan)对3个随机视野计数,计算细胞数。
流式细胞术
通过流式细胞术评估细胞周期和细胞凋亡。膜联蛋白 V-异硫氰酸荧光素 (10 µL) 和碘化丙啶 (PI; 5 µL, Sigma) 与细胞一起孵育 (5 × 10 5 细胞/孔)在 4°C 下避光 30 分钟。使用流式细胞仪(BD Biosciences,CA,USA)和 FlowJo 版本 10 软件(FlowJo LLC,OR,USA)计算凋亡细胞的百分比。
为了评估细胞周期,细胞(5 × 10 5 细胞/孔)在 4°C 下用 75% 乙醇固定过夜,并在 4°C 下用 5 µl PI/核糖核酸酶 A(Sigma)在黑暗中染色 30 分钟。用流式细胞仪(BD Biosciences)分析数据。使用 ModFit LT 3.2 版软件(Verity Software House, Inc., ME, USA)收集并计算每个样品的荧光信号 (14,000)。
裸鼠皮下肿瘤发生
从吉林大学实验动物中心(中国长春)获得 42 只雌性 BALB/c-nu 裸鼠(年龄 4 w,重 16-24 g)。将裸鼠分为14组(n =3)。 7组裸鼠按细胞分组分别注射KYSE-30细胞,其余7组裸鼠按细胞分组分别注射Eca109细胞。将转染的KYSE-30和Eca109细胞浓度调整为5 × 10 6 细胞/100 μL。将裸鼠固定并在无菌条件下皮下注射相应的ESCC细胞。每周测量肿瘤的最大长度(L)和最大宽度(W)和肿瘤体积(V ) =1/2 × L × W 2 .裸鼠在第5 th 注射一周后切除肿瘤,称重并拍照。成瘤率计算为皮下肿瘤小鼠数/组内注射裸鼠总数 × 100%。以注射时间为横坐标,以肿瘤大小为纵坐标;从而绘制出肿瘤生长曲线。
免疫组化染色
裸鼠肿瘤组织经10%甲醛固定,石蜡包埋,4 μm切片。接下来,切片在 60 °C 下干燥 2 h,二甲苯脱蜡,梯度乙醇脱水,并与 50 μL 3% H2O2 孵育 10 min。之后,切片在 0.01 M 柠檬酸缓冲液中浸泡,95 ℃煮沸 20 分钟,用普通山羊血清工作液 37 ℃封闭 10 分钟,加入 CD34(1:100,Santa Cruz)在4°C 过夜。然后,切片补充HRP标记的山羊抗兔/小鼠IgG聚合物(ZSGB-Bio,北京,中国),苏木精复染,脱水透化,然后用中性香脂密封。用 PBS 代替一抗作为 NC。微血管密度(MVD)的测量:在低倍显微镜下观察切片。内皮细胞或内皮细胞簇染成棕黄色,与周围肿瘤细胞明显区别,以结缔组织为微血管。如果分支结构断开,则也将其视为血管,而排除管腔尺寸> 8个红细胞,肌肉层或管腔较厚的血管。记录3个高视野微血管数,平均数为每例MVD。
统计分析
所有统计分析均使用 SPSS 版本 SPSS 21.0 软件(IBM Corp. Armonk,NY,USA)进行,并使用 Graphpad Prism 软件 6.0 呈现。数据表示为平均值 ± 标准偏差。两个独立组之间的差异使用学生 t 检验进行测试。进行单向方差分析以比较三个或更多组。 P 值 <0.05表示差异有统计学意义。
结果
MiR-301 高表达,而 PTEN 在 ESCC 组织和细胞中低表达
使用 RT-qPCR 和蛋白质印迹分析评估 ESCC 组织和邻近正常组织中 MiR-301 和 PTEN 的表达以揭示它们在 ESCC 中的作用,发现(图 1a-c)miR-301 上调,而 PTEN在 ESCC 组织中下调。根据miR-301或PTEN表达的中值将患者分为低表达组和高表达组,分析miR-301或PTEN表达与ESCC患者临床病理特征的相关性。结果表明,miR-301/PTEN的表达与年龄、性别、肿瘤大小、位置和分化无关,而与ESCC患者的TNM分期和LNM相关(表2)。
<图片>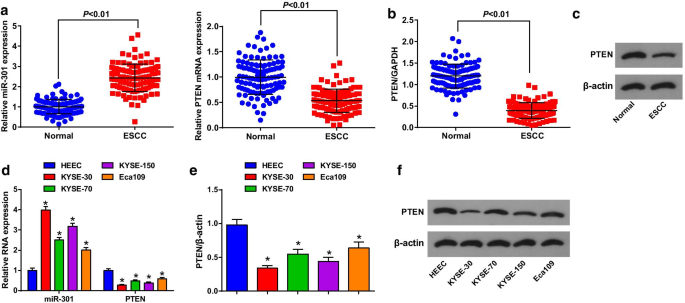
MiR-301 高表达,而 PTEN 在 ESCC 组织和细胞中低表达。 一 RT-qPCR检测ESCC组织miR-301表达及PTEN mRNA表达; b 使用蛋白质印迹分析检测 ESCC 组织中 PTEN 的蛋白质表达; c Western blot分析ESCC组织中PTEN蛋白条带; d RT-qPCR检测ESCC细胞系miR-301表达和PTEN mRNA表达; e 使用蛋白质印迹分析检测 ESCC 细胞系中 PTEN 的蛋白质表达; f 蛋白质印迹分析中 PTEN 的蛋白质条带。 *P <0.05 与 HEEC。数据以均值 ± 标准差表示,两组比较采用t检验
然后,使用 RT-qPCR 和蛋白质印迹分析确定 4 个 ESCC 细胞系和 HEEC 中 miR-301 和 PTEN 的表达。我们发现(图1d-f)miR-301在ESCC细胞系中上调而PTEN下调,其中KYSE-30的miR-301表达最高,PTEN表达最低,而Eca109则相反。因此,在细胞实验中,KYSE-30细胞系用下调的miR-301/过表达的PTEN处理,Eca109细胞系用过表达的miR-301/沉默的PTEN处理。
PTEN 是 miR-301 的目标
生物信息学软件(http://www.microrna.org/)预测 PTEN 是 miR-301 的靶基因(图 2a)。双荧光素酶报告基因检测进一步证实,与 PTEN-mut 载体和 miR-301 模拟物共转染的细胞相比,与 PTEN-mut 载体和 miR-301 模拟物共转染的 ESCC 细胞相比,荧光素酶活性显着降低,暗示miR-301可以特别结合PTEN(图2b,c)。
<图片>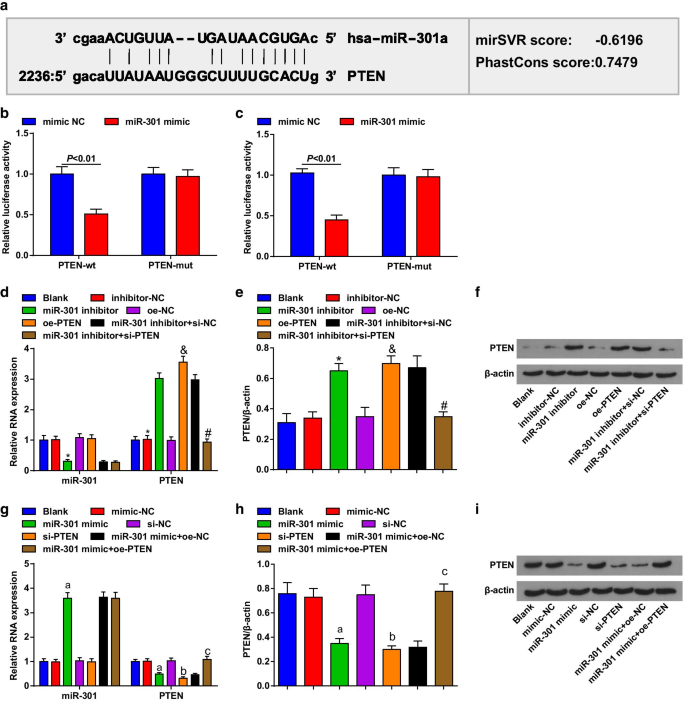
PTEN 是 miR-301 的靶基因。 一 通过在线预测软件预测miR-301和PTEN的结合位点; b 通过双荧光素酶报告基因检测评估 KYSE-30 细胞中 miR-301 和 PTEN 之间的靶标关系; c 通过双荧光素酶报告基因测定评估Eca109细胞中miR-301和PTEN之间的靶标关系; d 在miR-310下调或PTEN上调后使用RT-qPCR检测KYSE-30细胞中miR-301和PTEN mRNA的表达; e miR-310下调或PTEN上调后,使用蛋白质印迹分析检测KYSE-30细胞中PTEN的蛋白表达; f miR-310下调或PTEN上调后的蛋白质印迹分析中KYSE-30细胞中PTEN的蛋白条带; g 在miR-310上调或PTEN下调后,使用RT-qPCR检测Eca109细胞中miR-301的表达和PTEN的mRNA表达; h 在miR-310上调或PTEN下调后,使用蛋白质印迹分析检测Eca109细胞中PTEN的蛋白表达; 我 在 miR-310 上调或 PTEN 下调后的蛋白质印迹分析中,Eca109 细胞中 PTEN 的蛋白条带。 *P <0.05 与抑制剂-NC 组相比,&P <0.05 与 oe-NC 组相比, # P <0.05 与 miR-301 抑制剂 + si-NC 组相比,P <0.05 与模拟-NC 组相比,b P <0.05 与 si-NC 组相比,c P <0.05 与 miR-301 模拟物 + oe-NC 组相比; N =3.数据以均值 ± 标准差表示,两组比较采用t检验。多组间比较采用方差分析
RT-qPCR 和蛋白质印迹分析用于评估转染细胞中 miR-301 和 PTEN 的表达,发现在 KYSE-30 细胞中(图 2d-f),用 miR-301 抑制剂处理的细胞下调 miR-301 ,同时上调 PTEN;用 pcDNA-PTEN (oe-PTEN) 处理的细胞提高了 PTEN 表达,而 si-PTEN 逆转了 miR-301 抑制剂对 PTEN 表达的影响。在 Eca109 细胞中(图 2g-i),用 miR-301 处理的细胞模拟上调 miR-301,而下调 PTEN;用 si-PTEN 处理的细胞降低了 PTEN 表达,并且 pcDNA-PTEN (oe-PTEN) 逆转了 miR-301 模拟物在 PTEN 表达中的抑制作用。这些数据表明miR-301靶向PTEN。
抑制的 miR-301 或过度表达的 PTEN 限制了 ESCC 细胞的活力;升高的 miR-301 或降低的 PTEN 促进 ESCC 细胞的活力
使用集落形成和 CCK-8 测定评估 ESCC 细胞的细胞活力。结果显示,在KYSE-30细胞系(图3a-c)中,转染miR-301抑制剂或oe-PTEN抑制集落形成能力和细胞活力;沉默PTEN的转染消除了miR-301抑制剂对ESCC细胞活力的影响;在 Eca109 细胞系中(图 3d-f),转染 miR-301 模拟物或 si-PTEN 促进了集落形成能力和细胞活力; PTEN 过表达逆转了 miR-301 升高对 Eca109 细胞集落形成能力和活力的促进作用。这些结果表明miR-301敲低或PTEN过表达抑制了ESCC细胞的活力,而miR-301升高或PTEN抑制则促进了这种活力。
<图片>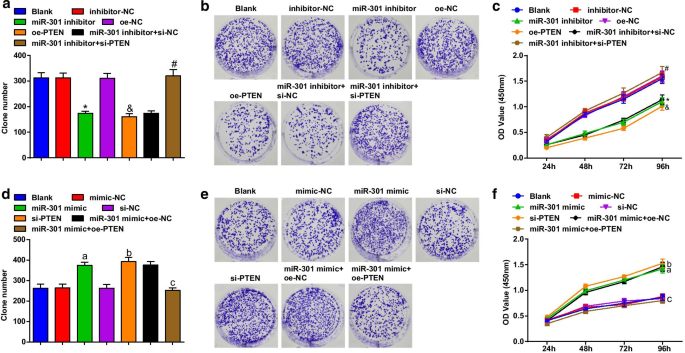
抑制的 miR-301 或过度表达的 PTEN 限制了 ESCC 细胞的活力;升高的 miR-301 或降低的 PTEN 可促进 ESCC 细胞的活力。 一 在miR-310下调或PTEN上调后使用集落形成试验检测转染后KYSE-30细胞中的集落数; b 在miR-310下调或PTEN上调后,使用集落形成试验检测转染后KYSE-30细胞的集落形成能力; c 在miR-310下调或PTEN上调后使用CCK-8测定检测转染后KYSE-30细胞的活力; d 转染后 Eca109 细胞中的集落数在 miR-310 上调或 PTEN 下调后使用集落形成试验检测; e miR-310上调或PTEN下调后集落形成试验检测转染后Eca109细胞集落形成能力; f 在 miR-310 上调或 PTEN 下调后使用 CCK-8 测定检测转染后 Eca109 细胞的活力; *P <0.05 与抑制剂-NC 组相比; &P <0.05 与 oe-NC 组相比; # P <0.05与miR-301抑制剂 + si-NC组相比; P <0.05 与模拟-NC 组相比; b P <0.05 与 si-NC 组相比; c P <0.05 vs miR-301模拟物 + oe-NC组,N =3.数据以均值 ± 标准差表示,多组间比较采用方差分析
抑制的 miR-301 或过表达的 PTEN 抑制 ESCC 细胞的迁移和侵袭;升高的 miR-301 或降低的 PTEN 诱导 ESCC 细胞的迁移和侵袭
使用 Transwell 测定评估 ESCC 细胞的迁移和侵袭能力。结果表明,在KYSE-30细胞系中(图4a,b),细胞迁移和侵袭能力受到抑制miR-301或过表达PTEN的抑制; miR-301抑制剂在细胞迁移和侵袭能力中的抑制作用被si-PTEN逆转。在Eca109细胞系中(图4c、d),转染miR-301模拟物或si-PTEN后细胞迁移和侵袭能力得到促进;过表达的 PTEN 逆转了 miR-301 模拟物对细胞迁移和侵袭能力的影响。上述结果表明,miR-301抑制或PTEN升高可抑制ESCC细胞的迁移和侵袭,而miR-301上调或PTEN下调则促进其迁移和侵袭。
<图片>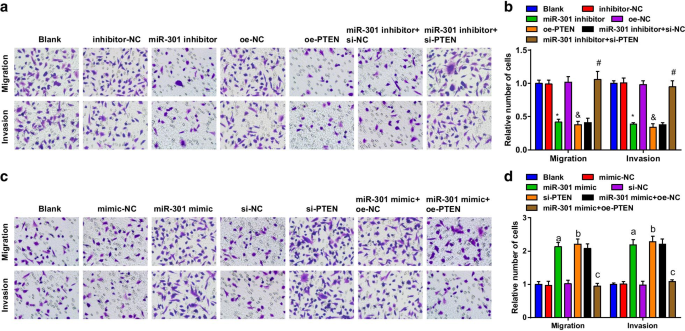
抑制 miR-301 或过表达 PTEN 抑制 ESCC 细胞的迁移和侵袭;升高的 miR-301 或降低的 PTEN 促进 ESCC 细胞的迁移和侵袭。 一 在miR-310下调或PTEN上调后使用Transwell测定评估转染的KYSE-30细胞的迁移和侵袭能力; b miR-310下调或PTEN上调后通过Transwell测定在KYSE-30细胞中迁移和侵袭的统计结果; c Eca109 细胞在 miR-310 上调或 PTEN 下调后使用 Transwell 测定评估的组间迁移和侵袭能力; d 通过Transwell测定miR-310上调或PTEN下调在Eca109细胞中迁移和侵袭的统计结果。 *P <0.05 与抑制剂-NC 组相比; &P <0.05 与 oe-NC 组相比; # P <0.05与miR-301抑制剂 + si-NC组相比; P <0.05 与模拟-NC 组相比; b P <0.05 与 si-NC 组相比; c P <0.05 vs miR-301模拟物 + oe-NC组,N =3.数据以均值 ± 标准差表示,多组间比较采用方差分析
抑制 miR-301 或过表达 PTEN 诱导 ESCC 细胞的细胞周期停滞和凋亡;升高的 miR-301 或降低的 PTEN 抑制 ESCC 细胞的细胞周期停滞和凋亡
流式细胞术检测转染后细胞的细胞周期转变和凋亡,结果表明在KYSE-30细胞系中(图5a-d),转染miR-301抑制剂或oe-PTEN促进了细胞凋亡率G0/G1期细胞增多,S期和G2/M期细胞减少; si-PTEN可以逆转miR-301抑制剂诱导的细胞凋亡和细胞周期阻滞的改变。
<图片>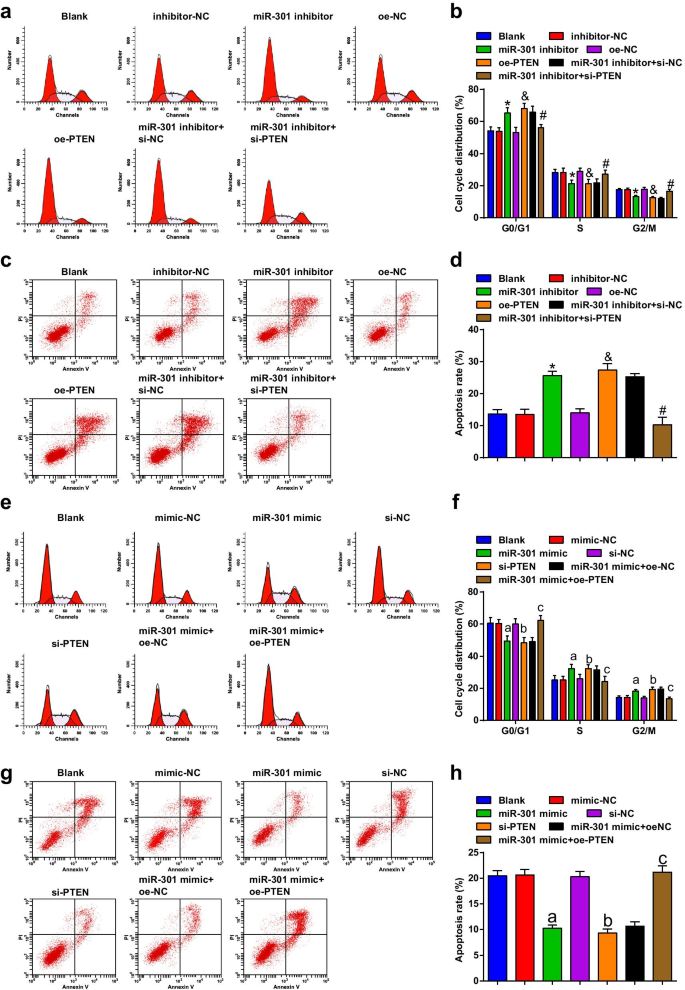
抑制 miR-301 或过表达 PTEN 诱导 ESCC 细胞的细胞周期停滞和凋亡;升高的 miR-301 或降低的 PTEN 抑制 ESCC 细胞的细胞周期停滞和凋亡。 一 miR-310下调或PTEN上调后流式细胞仪检测各组KYSE-30细胞的细胞周期分布; b miR-310下调或PTEN上调后流式细胞术中KYSE-30细胞G0/G1、S和G2/GM期百分比统计结果; c miR-310下调或PTEN上调后流式细胞术检测KYSE-30细胞凋亡; d 在miR-310下调或PTEN上调后使用流式细胞术检测转染的KYSE-30细胞的凋亡率; e 流式细胞仪miR-310上调或PTEN下调检测各组Eca109细胞周期分布; f miR-310上调或PTEN下调后流式细胞术中Eca109细胞G0/G1、S和G2/GM期百分比统计结果; g 流式细胞术检测miR-310上调或PTEN下调后Eca109细胞凋亡; h 在 miR-310 上调或 PTEN 下调后,使用流式细胞术检测转染的 Eca109 细胞的凋亡率。 *P <0.05 与抑制剂-NC 组相比; &P <0.05 与 oe-NC 组相比; # P <0.05与miR-301抑制剂 + si-NC组相比; P <0.05 与模拟-NC 组相比; b P <0.05 与 si-NC 组相比; c P <0.05 vs miR-301模拟物 + oe-NC组,N =3.数据以均值 ± 标准差表示,多组间比较采用方差分析
根据流式细胞术的结果,我们发现在 Eca109 细胞系(图 5e-h)中,转染 miR-301 模拟物或 si-PTEN 抑制了细胞凋亡率,降低了 G0/G1 期细胞的凋亡率,增加了S期和G2/M期; PTEN 过表达逆转了 miR-301 模拟物对 Eca109 细胞凋亡率和细胞周期停滞的影响。我们从这些结果得出结论,下调miR-301或上调PTEN促进ESCC细胞的细胞周期转变和凋亡,而抑制miR-301或沉默PTEN则产生相反的作用。
抑制 miR-301 或过度表达的 PTEN 在 ESCC 中抑制体内肿瘤生长和血管生成;升高的 miR-301 或降低的 PTEN 增加 ESCC 体内肿瘤生长和血管生成
观察各组裸鼠ESCC肿瘤的生长和变化。评估肿瘤生长,结果表明在 KYSE-30 细胞系(图 6a-e)中,注射 miR-301 抑制剂或 oe-PTEN 的裸鼠减少了肿瘤体积和重量; si-PTEN 消除了 miR-301 抑制剂在肿瘤生长中的抑制作用。在 Eca109 细胞系(图 6f-j)中,注射 miR-301 模拟物或 si-PTEN 的裸鼠的肿瘤体积和肿瘤重量增加; PTEN 的过表达逆转了 miR-301 模拟物对肿瘤生长的影响。同时,使用免疫组织化学染色评估了裸鼠异种移植物中 CD34 的表达,结果显示(图 7a-d)在 KYSE-30 异种移植物中,miR-301 下调或 PTEN 上调后 MVD 受到抑制;沉默的 PTEN 逆转了 miR-301 抑制对 MVD 的影响。在 Eca109 异种移植物中,miR-301 上调或 PTEN 下调后 MVD 增加;过表达的 PTEN 可以消除由上调 miR-301 诱导的 MVD 增强。 These data indicated that miR-301 inhibition or PTEN overexpression repressed tumor growth and angiogenesis in ESCC, while miR-301 elevation or PTEN silencing had reverse effects.
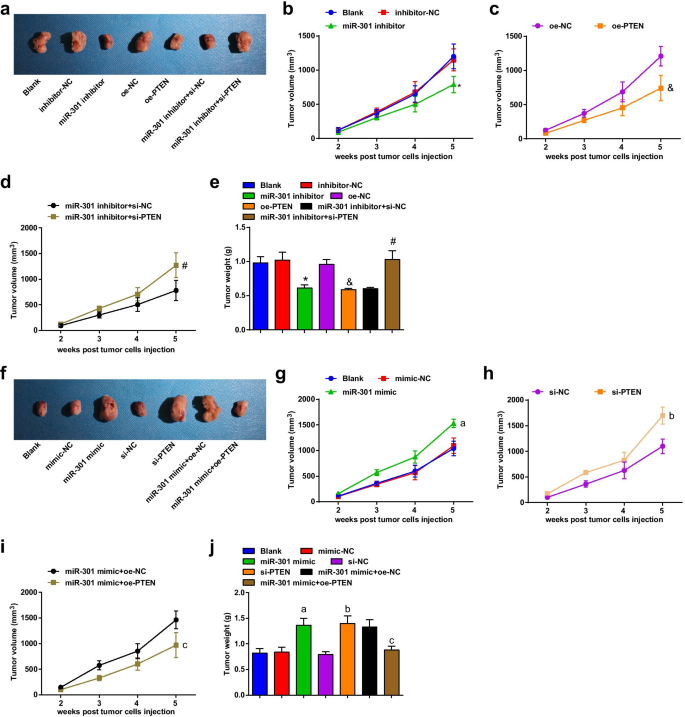
Inhibited miR-301 or overexpressed PTEN restrains tumor growth in ESCC; elevated miR-301 or reduced PTEN increases tumor growth in ESCC. 一 Representative figures for the tumor growth observed by subcutaneous tumorigenesis in nude mice after KYSE-30 cells were transfected; b–d changes of tumor volume of each group after KYSE-30 cells were transfected; e changes of tumor weight of each group after KYSE-30 cells were transfected; f representative figures for the tumor growth observed by subcutaneous tumorigenesis in nude mice after Eca109 cells were transfected; g–i changes of tumor volume of each group after Eca109 cells were transfected; j changes of tumor weight of each group after Eca109 cells were transfected. *P < 0.05 versus the inhibitor-NC group; &P < 0.05 versus the oe-NC group; # P < 0.05 versus the miR-301 inhibitors + si-NC group; a P < 0.05 versus the mimic-NC group; b P < 0.05 versus the si-NC group; c P < 0.05 versus the miR-301 mimic + oe-NC group, n = 3 mice. Data were expressed as mean ± standard deviation, and ANOVA was used for comparisons among multiple groups
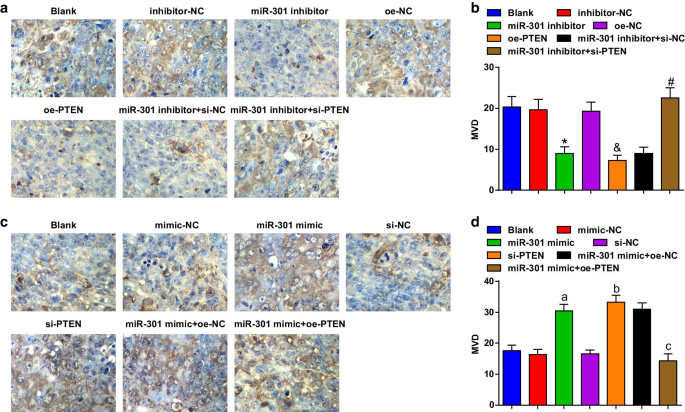
Inhibited miR-301 or overexpressed PTEN restrains angiogenesis in ESCC; elevated miR-301 or reduced PTEN increases angiogenesis in ESCC. 一 Representative images of tumor tissues observed by immunohistochemical staining in nude mice after KYSE-30 cells were transfected; b comparisons of MVD of KYSE-30 in tumor tissues among the groups; c representative images of tumor tissues observed by immunohistochemical staining in nude mice after Eca109 cells were transfected; d comparisons of MVD of Eca109 in tumor tissues among the groups *P < 0.05 versus the inhibitor-NC group; &P < 0.05 versus the oe-NC group; # P < 0.05 versus the miR-301 inhibitors + si-NC group; a P < 0.05 versus the mimic-NC group; b P < 0.05 versus the si-NC group; c P < 0.05 versus the miR-301 mimic + oe-NC group, n = 3 mice. Data were expressed as mean ± standard deviation, and ANOVA was used for comparisons among multiple groups
讨论
EC is a kind of invasive malignancy in the gastrointestinal tract [16]. As the major type of EC, ESCC is a malignant tumor occurring in esophageal epithelial cells [17]. The miRNAs, known as small non-coding RNAs, have been demonstrated to function as a significant roles in leading molecules in the silencing of RNA [18]. Our research was designed to explore the effects of miR-301 and its target gene PTEN on ESCC progression, and we have found that the inhibited miR-301 could suppress angiogenesis and cell growth in ESCC by elevating PTEN.
MiR-301 expression was assessed, and we found that miR-301 was highly expressed in ESCC cells in comparison with HEEC, and the higher expression of miR-301 has also been found in ESCC tissues in contrast to the adjacent normal tissues. Similar to this result, Li et al. have identified that miR-301 presented high expression in myocardial infarction tissues [19]. In addition, we have elucidated that PTEN was targeted by miR-301, and the target relation has been pointed out by an extant literature [20]. We have also discovered that PTEN, which has been affirmed to be targeted by miR-301, was downregulated in both ESCC tissues and cells. Similarly, a previous research has unearthed that PTEN was poorly expressed in ESCC compared with non-tumor esophageal epithelial tissue [21]. Furthermore, Ma et al. have illuminated that PTEN expression was degraded in Eca109 cell line [22], which has also been selected for a series of experiments in this research. These studies provide evidence for the high expression of miR-301 and low expression of PTEN in ESCC.
Another important outcome in this research indicated that the inhibited miR-301 could repress the colony formation ability as well as the cell proliferation of ESCC cells via enhancing the PTEN expression, and elevated miR-301 or reduced PTEN had contrary effects. Similarly, Han et al. have elucidated that the downregulation of miR-301 mediated by luteolin has the ability to restrain the cell proliferation in prostate cancer [6]. A recent literature has revealed that the overexpression of PTEN suppresses the proliferation of pancreatic cancer cells [23], and a same result has been summarized in a study focusing on prostate cancer [24]. Besides, we have also unearthed that the downregulation of miR-301 or the elevation of PTEN could inhibit migration and invasion of ESCC cells, and elevated miR-301 or reduced PTEN exhibited the opposite trends. In accordance with this outcome, Shi et al. have supported that inhibited miR-301 attenuated migration and invasion of breast cancer cells [10], and it has been reported that the migration and invasion of ESCC cells could be repressed by the inhibition of miR-130b and the elevation of PTEN [25]. These publications helped verifying the oncogenic role of miR-301 and tumor-repressive effect of PTEN in diverse human cancers. Another result in our research was that inhibited miR-301 overexpressed PTEN to promote cell apoptosis and induce cell cycle arrest at the G0/G1 phase in ESCC cells, and elevated miR-301 or reduced PTEN had the inverse results. Similarly, it has been uncovered by a recent literature that activated PTEN induces cell cycle arrest and apoptosis in ESCC [26]. Consistently, Tian et al. have found in their study that the elevation of PTEN inhibited the angiogenesis by reducing the expression of vascular endothelial growth factor in hepatocellular carcinoma [27]. Based on the above data, the roles of miR-301 and PTEN in cell apoptosis and angiogenesis in diverse diseases were further confirmed. Consequently, we concluded that the downregulation of miR-301 could restrain the tumor growth in ESCC through the high expression of PTEN, and the similar conclusion has also been unveiled in breast cancer [10] and prostate cancer [28]. On the contrary, miR-301 elevation or PTEN reduction induced the tumor growth in ESCC. It could be concluded that miR-301 and PTEN participated in the in vivo cancer cell growth.
Conclusion
In this study, we have shown that the repression of miR-301 prohibits angiogenesis, cell proliferation, migration and invasion but promotes apoptosis in ESCC cells by upregulating PTEN. This research may further the understanding on potential molecular mechanisms of ESCC and provide novel targets for ESCC treatment.
缩写
- ESCC:
-
Esophageal squamous cell carcinoma
- PTEN:
-
Phosphatase and tensin homologue
- MVD:
-
微血管密度
- EC:
-
Esophageal cancer
- miRNAs:
-
MicroRNAs
- LNM:
-
Lymph node metastasis
- UICC:
-
Union for International Cancer Control
- RT-qPCR:
-
逆转录定量聚合酶链反应
- 3′UTR:
-
3′-Untranslated region
- WT:
-
Wild type
- MUT:
-
Mutant type
- HRP:
-
辣根过氧化物酶
- FBS:
-
胎牛血清
- OE:
-
Overexpressed
- NC:
-
阴性对照
- CCK-8:
-
Cell counting kit
- DMEM:
-
Dulbecco’s modified Eagle medium
- PI:
-
碘化丙啶
- FITC:
-
Fluorescein isothiocyanate
- MVD:
-
微血管密度
- ANOVA:
-
Analysis of variance
纳米材料
- microRNA-342-5p 的下调或 Wnt3a 的上调抑制血管生成并维持动脉粥样硬化小鼠的动脉粥样硬化斑块稳定性
- 负载 ICA 的 mPEG-ICA 纳米颗粒的制备及其在治疗 LPS 诱导的 H9c2 细胞损伤中的应用
- 聚合物纳米结构上 U2OS 细胞中肌动蛋白和焦点粘附组织的分析
- 通过原子层沉积和水热生长制备的抗菌聚酰胺 6-ZnO 分层纳米纤维
- Au 纳米颗粒对 HT29 和 SPEV 细胞系影响的体外研究
- 用 6-巯基嘌呤和神经元穿透肽修饰的金纳米颗粒促进 SH-SY5Y 细胞生长
- 磁赤铁矿纳米颗粒作为纳米酶,改善甘蓝型油菜的生长和非生物胁迫耐受性
- 圆形金纳米粒子:粒径和浓度对拟南芥根系生长的影响
- 支持直接甲醇燃料电池的新型阳极催化剂:表征和单电池性能
- InGaAs/InP 核壳纳米线的自种 MOCVD 生长和显着增强的光致发光
- 评估金纳米颗粒抑制的细胞色素 P450 3A4 活性及其在人肝细胞癌细胞系 C3A 中的细胞毒性的分子机制
- 5G 和指数数据增长的挑战


